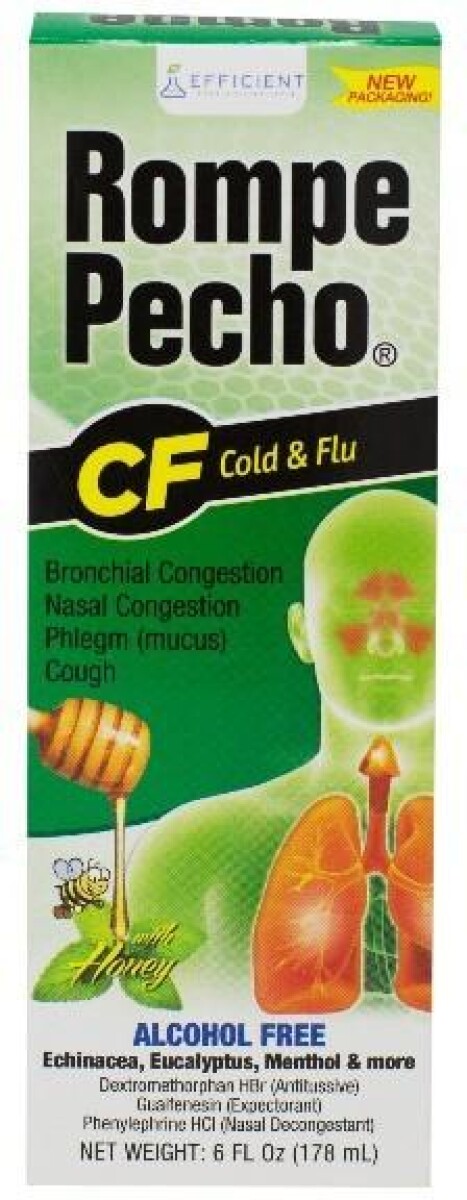
-Semglee®(甘精胰岛素注射液)。强度:100 单位/毫升 (U-100)。尺寸:3mL 预填充笔。NDC #49502 -196-75。批次编号:BF20003118。到期日:2022年8月
风险声明:对于接受多种胰岛素(例如短效和长效胰岛素)治疗的患者,Semglee®(甘精胰岛素)预填充笔上缺少标签,可能会导致产品/强度混淆,从而导致错误的胰岛素给药。
使用错误的胰岛素可能会导致血糖控制不太理想(无论是高血糖还是低血糖),从而导致严重的并发症。迄今为止,该公司尚未收到与此次召回相关的任何不良事件的报告。
此次召回与最近推出的可互换生物仿制药、品牌产品Semglee®(胰岛素glargine-yfgn)注射液或无品牌产品甘精胰岛素(glargine-yfgn)注射液无关。
该产品是一种长效人胰岛素类似物,用于改善患有1型糖尿病的成人和儿科患者以及患有2型糖尿病的成人的血糖控制,并且包装在五(5)支笔的纸箱中的预填充笔中。召回的商品可以通过缺少白色标签的预填充笔来识别,笔周围贴有产品名称和剂量信息。
该公司已开始召回 BF20003118 批次,并通知其分销商和 零售商通过信件发送,并正在安排退回所有召回的产品。以下是针对消费者、批发商和零售商的行动。
-消费者:如果您有未贴标的商品,请致电 1-888-843-0255 联系 Stericycle 以获取将商品退还给 Stericycle 的文档包。
-批发商:立即检查您的库存、隔离并停止分发此批次。此外,如果您进一步分发了该产品,请查看下面的链接以获取进一步的操作。
-零售商:立即检查您的库存,隔离并停止分发此批次。
公司名称:迈兰制药有限公司
品牌名称:Semglee
商品召回:甘精胰岛素注射液)、100…