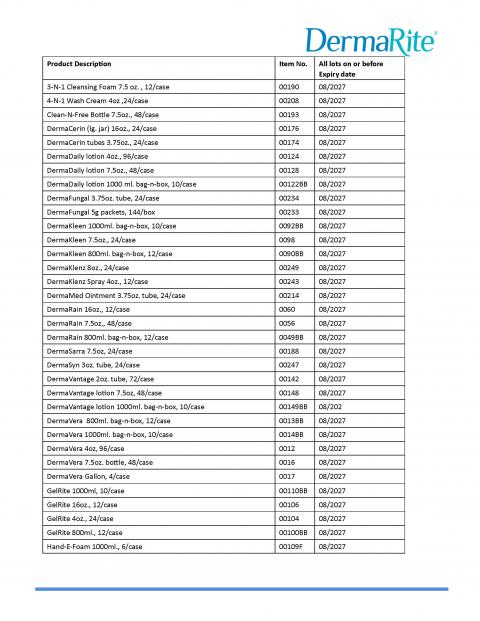
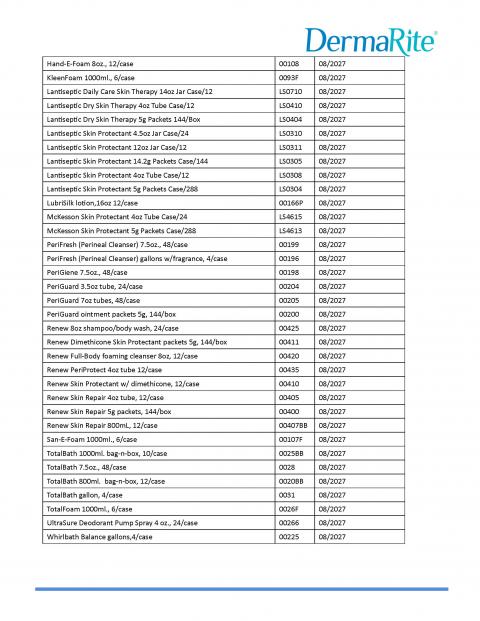
DerMarite Industries, LLC正在扩大7月16日启动的自愿召回范围,原因是潜在的微生物污染被确定为Burkholderia cepacia复合物。出于谨慎考虑,自愿召回范围已扩大到包括其他产品和批次,如下表所示。召回的产品在美国和波多黎各全国范围内分销。
此次扩大自愿召回中包含的产品包括:
-4-N-1 是一款无需冲洗的洗面霜,旨在暂时保护和帮助缓解皮肤擦伤或破裂的皮肤
-Dermacerin 是一种皮肤保护保湿霜,旨在暂时保护和帮助缓解干燥、干裂或开裂的皮肤。它还有助于保护皮肤免受风和寒冷天气的干燥影响。
-DermaFungal 是一种非处方抗真菌药膏,用于治疗和预防大多数脚气、股痒和癣。它可以缓解与这些疾病相关的瘙痒、脱皮、开裂和不适。
-Dermakleen 是一款非处方保健消毒洗剂香皂,含有维生素 E,适合洗手以减少皮肤上的细菌。
-DermaMed 是一种非处方皮肤保护剂,旨在干燥毒藤、橡树或漆树或其他皮肤刺激的渗出和哭泣。
-DermaSarra 是一种非处方外用镇痛药,适用于暂时缓解皮肤干燥、昆虫叮咬、洗涤剂或晒伤引起的轻微皮肤刺激引起的瘙痒。
-Gel Rite 是一款非处方速溶凝胶洗手液,含有维生素 E,用于减少皮肤上的细菌。建议重复使用。
-Hand E Foam 是一款非处方泡沫洗手液,含有维生素 E,用于洗手,减少皮肤上的细菌。建议重复使用。
-KleenFoam 是一款非处方抗菌泡沫肥皂,含有芦荟,可在更换尿布、帮助病人后洗手,以减少皮肤上的细菌,或 在与接受医疗或治疗的人接触之前。
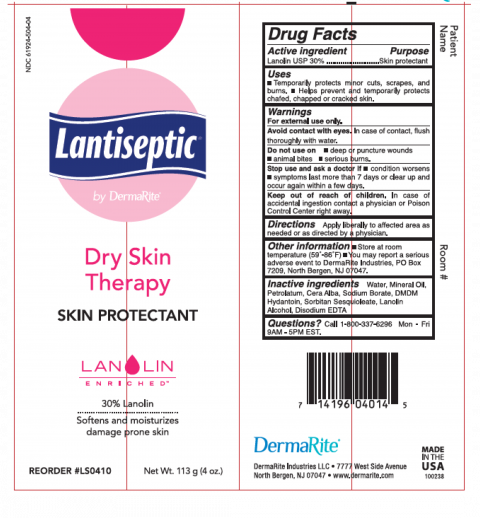
-Lantiseptic 是一种非处方皮肤保护剂,可暂时保护轻微割伤、擦伤和烧伤。它有助于防止和暂时保护干裂或破裂的皮肤。
-PeriGiene 是一款非处方消毒清洁剂,适用于会阴部位。
-PeriGuard 是一种非处方皮肤保护剂,旨在帮助缓解和预防尿失禁引起的潮湿引起的皮疹和刺激。它还可以保护因刺激而擦伤的皮肤,并有助于阻隔湿气。
-Renew Dimethicone 是一种非处方皮肤保护剂,旨在帮助治疗和预防尿布疹,保护与尿布疹相关的轻微皮肤刺激,并有助于阻隔湿气。
-Renew Periprotect 是一种非处方皮肤保护剂,旨在帮助治疗和预防尿布疹,保护与尿布疹相关的轻微皮肤刺激,并有助于阻隔湿气。
-Renew Skin Repair 是一款非处方护肤霜,旨在暂时保护和帮助缓解干裂或破裂的皮肤。它对脸部、手部、身体和腿部都有好处。
-UltraSure…
更多