Ascend Laboratories Dabigatran Etexilate 胶囊——因检测到 N-亚硝基二甲胺杂质而召回, USA
1年前 •source fda.gov • 细节
Recall notice
亚硝胺在水和食物中很常见,包括腌制和烧烤肉类、乳制品和蔬菜。每个人都暴露于一定程度的亚硝胺。如果人们长期接触这些杂质超过可接受的水平,则可能会增加患癌的风险。该产品用作口服抗凝剂,以降低中风和血栓的风险。
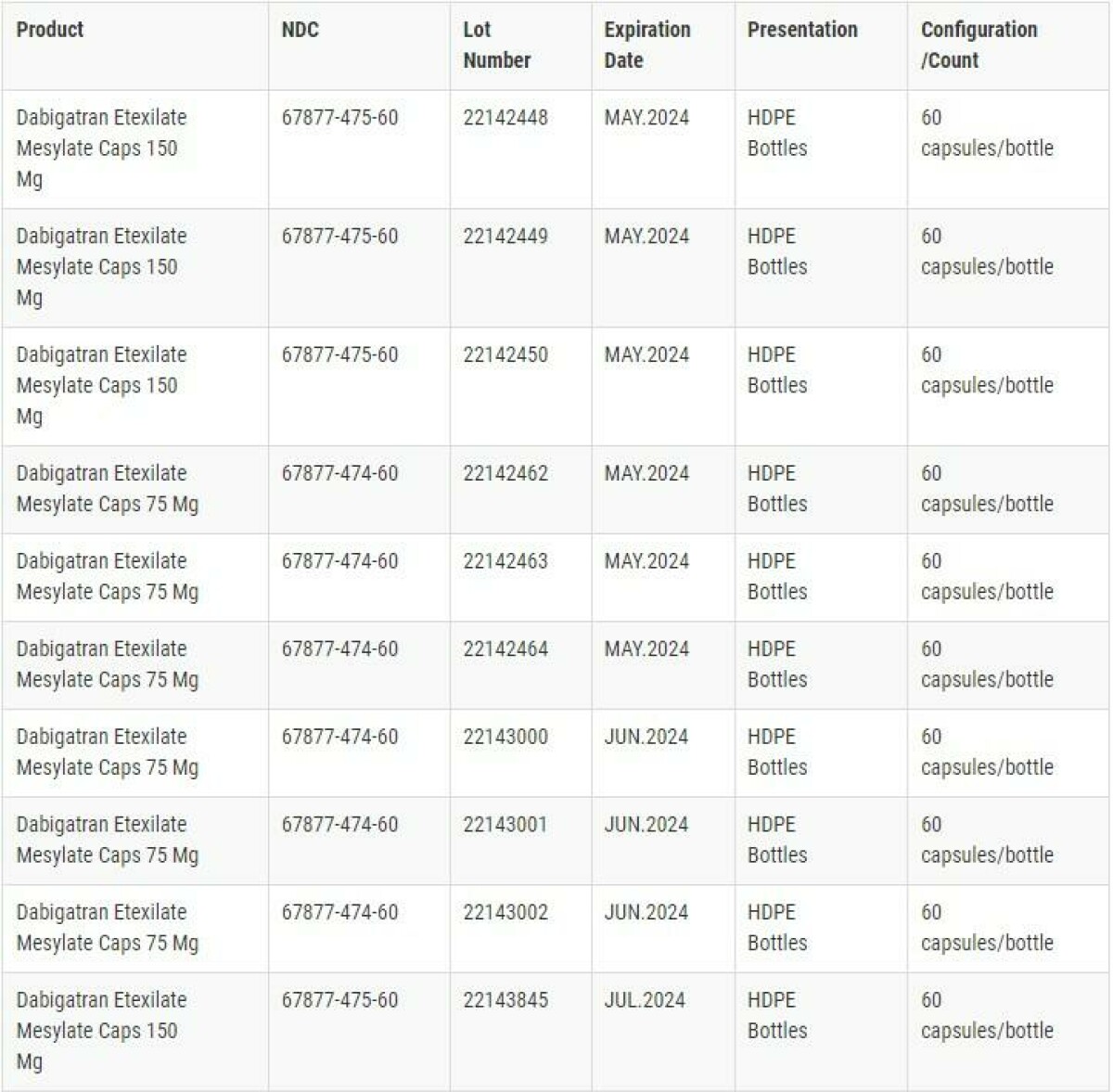
NDC。批号。本次召回的Dabigatran Etexilate胶囊的有效期和包装配置详情如下图所示。
如果您因这些产品而受到伤害,请务必举报。它可以帮助检测和解决问题,防止他人受到伤害,还可以进行更好的监控。如果症状持续,请就医。
公司名称:Ascend Laboratores LLC
品牌名称:Ascend 实验室
产品召回:Dabigatran Etexilate 胶囊,USP
召回原因:检测到 N-亚硝基二甲胺 (NDMA) 杂质
美国食品药品管理局召回日期:2023 年 3 月 22 日
资料来源:www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/ascend-laboratories-llc-issues-voluntary-nationwide-recall-dabigatran-etexilate-capsules-usp-75-mg