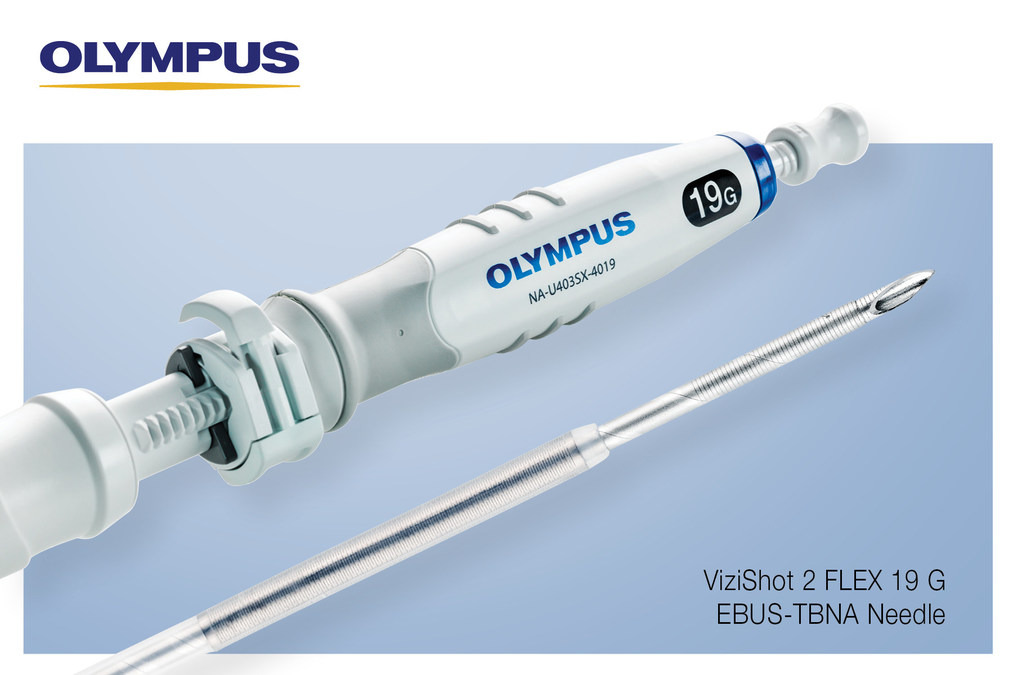
Recall notice
Las agujas ViziShot 2 FLEX (19G) EBUS -TBNA retiradas del mercado debido a que los componentes del dispositivo pueden desprenderse durante los procedimientos, USA
hace 5 meses •source fda.gov
United States
Actualización del 16 de enero de 2026:Olympus ha ampliado su retirada voluntaria a nivel mundial de las agujas EBUS-TBNA de ViziShot 2 FLEX (19G) para incluir todos los lotes, en sustitución de la acción anterior de agosto de 2025 que se aplicaba solo a lotes específicos. La expansión se produce tras una investigación más profunda sobre las quejas relacionadas con la expulsión o el desprendimiento de componentes del dispositivo durante los procedimientos, incluidos los informes de lesiones de un paciente y una muerte.
Olympus identificó otros factores que influyen en todos los lotes, como la degradación del material termorretráctil y los problemas relacionados con el uso, que pueden provocar la rotura de los componentes, la fuga de fluido, el deterioro del despliegue o la retracción de la aguja y la dificultad para extraer las muestras.
Otras agujas EBUS-TBNA no se ven afectadas por esta acción.
Fuente: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/olympus-expands-voluntary-recall-vizishot-2-flex-19g-ebus-tbna-needles
22 de septiembre de 2025:
Olympus Corporation ha anunciado una acción global y voluntaria para retirar los dispositivos médicos de las agujas ViziShot 2 FLEX (19G) EBUS-TBNA («ViziShot 2 FLEX») fabricadas antes del 12 de mayo de 2025, tras recibir informes sobre la separación de componentes del dispositivo durante los procedimientos.
La ViziShot 2 FLEX está protegida por un hipotubo y una funda. El hipotubo protege la funda de la punta de la aguja y proporciona estabilidad durante el transporte y la inserción. Si se ha producido un daño en la funda y el dispositivo se sigue utilizando, el hipotubo puede expulsarse del dispositivo junto con los componentes de plástico desprendidos, que no son radiopacos. También pueden producirse daños durante el proceso de fabricación. Para mejorar la detección de daños en los dispositivos en el punto de fabricación, Olympus implementó un procedimiento de inspección automatizado durante el montaje, un paso que anteriormente se realizaba mediante inspección visual.
El ViziShot 2 FLEX está diseñado para usarse con endoscopios ecográficos para la aspiración con aguja fina (FNA) guiada por ultrasonido y la biopsia con aguja fina (FNB) de lesiones submucosas y extramurales del árbol traqueobronquial.
Olympus evaluó el problema tras recibir quejas sobre efectos adversos relacionados con lesiones de un paciente y la muerte de un paciente. Las posibles consecuencias de la separación de un componente del ViziShot 2 FLEX incluyen el riesgo de que se introduzcan componentes no deseados del dispositivo en el árbol traqueobronquial que puedan requerir una extracción broncoscópica o una extirpación quirúrgica.
Fuente: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/olympus-issues-voluntary-recall-specific-lots-vizishot-2-flex-19g-ebus-tbna-needles
Comentarios
Comentario