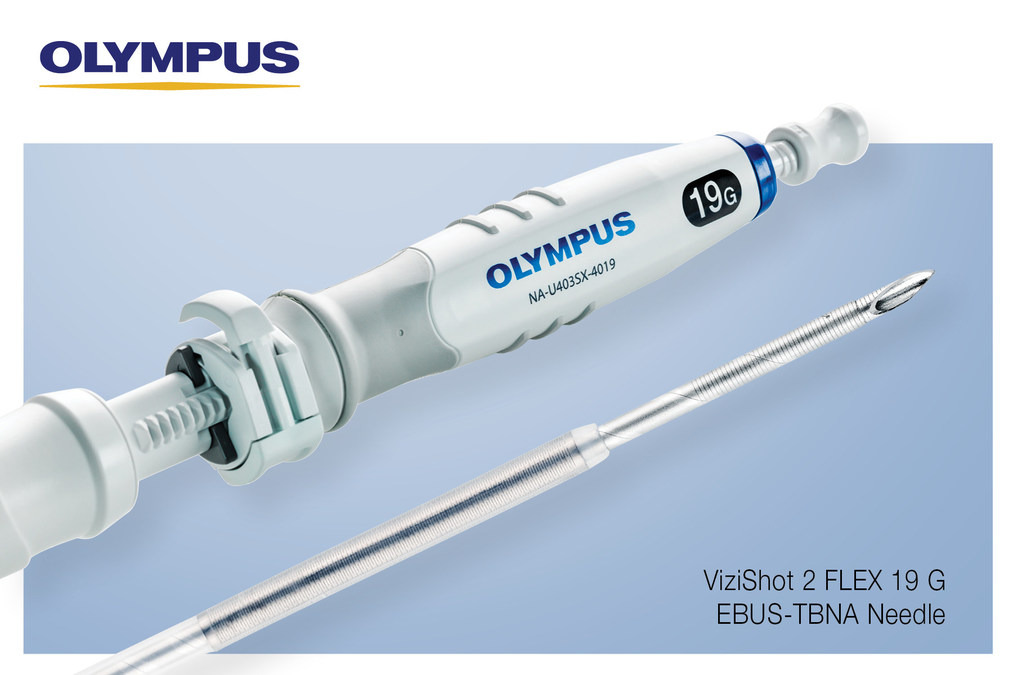
Recall notice
Agulhas ViziShot 2 FLEX (19G) EBUS-TBNA retiradas devido ao fato de que os componentes do dispositivo podem se soltar durante os procedimentos, USA
há 5 meses •source fda.gov
United States
Atualização em 16 de janeiro de 2026:A Olympus expandiu sua remoção global voluntária das agulhas EBUS-TBNA ViziShot 2 FLEX (19G) para incluir todos os lotes, substituindo a ação anterior de agosto de 2025 que se aplicava somente a lotes específicos. A expansão segue uma investigação mais aprofundada sobre reclamações envolvendo ejeção ou desprendimento de componentes do dispositivo durante procedimentos, incluindo relatos de ferimentos de pacientes e uma morte.
A Olympus identificou outros fatores contribuintes que afetam todos os lotes, incluindo degradação do material termorretrátil e problemas relacionados ao uso, que podem levar à quebra de componentes, vazamento de fluido, comprometimento da implantação ou retração da agulha e dificuldade na extração de amostras.
Outras agulhas EBUS-TBNA não são afetadas por esta ação.
Fonte: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/olympus-expands-voluntary-recall-vizishot-2-flex-19g-ebus-tbna-needles
22 de setembro de 2025:
A Olympus Corporation anunciou uma ação voluntária e global de remoção de dispositivos médicos para as agulhas ViziShot 2 FLEX (19G) EBUS-TBNA (“ViziShot 2 FLEX”) fabricadas antes de 12 de maio de 2025, após receber relatórios de que componentes do dispositivo se soltaram durante os procedimentos.
O ViziShot 2 FLEX é protegido por um hipotubo e uma capa. O hipotubo protege a bainha da ponta da agulha e fornece estabilidade durante o trânsito e a inserção. Se ocorrerem danos na bainha e o dispositivo continuar sendo usado, o hipotubo tem o potencial de ser ejetado do dispositivo junto com componentes plásticos separados, que não são radiopacos. Danos também podem ocorrer durante o processo de fabricação. Para melhorar a detecção de danos no dispositivo no ponto de fabricação, a Olympus implementou um procedimento de inspeção automatizado durante a montagem, uma etapa que havia sido conduzida anteriormente por meio de inspeção visual.
O ViziShot 2 FLEX foi projetado para ser usado com endoscópios de ultrassom para aspiração por agulha fina guiada por ultrassom (FNA) e biópsia por agulha fina (FNB) de lesões submucosas e extramurais da árvore traqueobrônquica.
A Olympus avaliou o problema após receber reclamações de eventos adversos envolvendo ferimentos em pacientes e uma morte. As possíveis consequências de um componente separado do ViziShot 2 FLEX incluem o risco de componentes não intencionais do dispositivo dentro da árvore traqueobrônquica que podem exigir extração broncoscópica ou remoção cirúrgica.
Fonte: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/olympus-issues-voluntary-recall-specific-lots-vizishot-2-flex-19g-ebus-tbna-needles
Comentários
Comentário