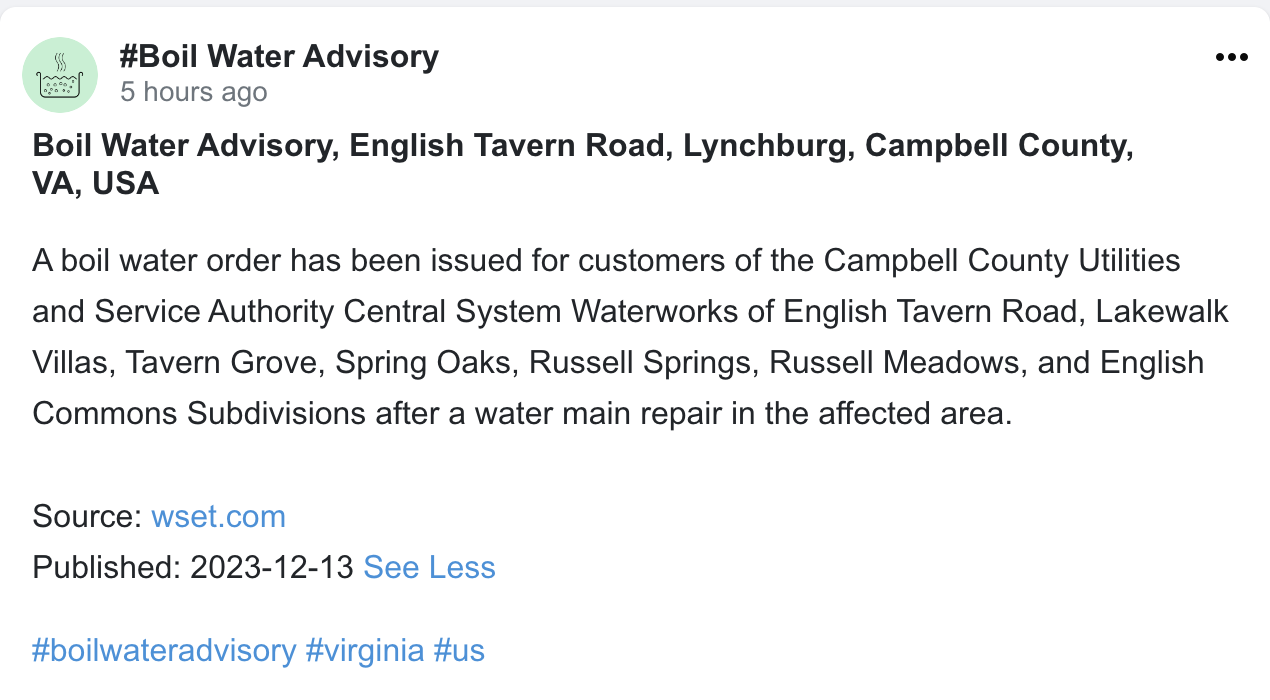
Sobre nosotros
Misión de SafelyHQ
SafelyHQ se fundó para aprovechar el poder de las experiencias compartidas de los consumidores para lograr un impacto en la comunidad. Nuestro equipo aporta experiencia en crowdsourcing, verificación de datos, análisis y comunicaciones. Esta plataforma se basa en el poder del conocimiento compartido. Recopilamos los informes de los consumidores sobre problemas críticos de la comunidad, que van desde cortes de energía hasta alertas de fraude y avisos de agua hervida, y también analizamos las fuentes en línea en busca de avisos relacionados de entidades locales y plataformas de redes sociales. Al centralizar todos estos informes en tiempo real en un solo lugar, organizados por etiquetas de ubicación y tema, como #PowerOutage, #BoilWaterAdvisory o #Boston, empoderamos a las comunidades para que se mantengan informadas y, al mismo tiempo, proporcionamos información clave a la industria y las agencias. Nuestros procesos de verificación tienen como objetivo garantizar la autenticidad de los informes, de modo que nuestra plataforma proporcione una visión fiable de los problemas emergentes. Al detectar las tendencias de manera temprana y acelerar la resolución de problemas, creemos que desarrollar la transparencia basada en la tecnología a gran escala puede transformar las comunidades creando nuevos niveles de responsabilidad, capacidad de respuesta y, en última instancia, seguridad y bienestar
para todos.Cómo funciona, nuestro proceso
- En SafelyHQ, simplificamos el complejo proceso desde la notificación de problemas hasta su resolución. Comienza cuando usted, el consumidor, informa sobre una inquietud en SafelyHQ. SafelyHQ también se basa directamente en informes de noticias, sitios gubernamentales, redes sociales y sitios comunitarios para resaltar las preocupaciones.
- Todos los informes de los consumidores sobre SafelyHQ reciben tanto una revisión humana como una revisión técnica de fondo. Estas reseñas están diseñadas para eliminar las denuncias maliciosas o no auténticas. El uso indebido o malintencionado del sitio por parte de los usuarios también va en contra de nuestra política de condiciones de uso. Nuestro compromiso es garantizar, de la mejor manera posible, que cada informe represente una observación auténtica de una persona real.
- Durante todo este proceso, desde el informe hasta la publicación pública, mantenemos la transparencia y mantenemos a nuestra comunidad actualizada, fomentando una esfera pública proactiva e informada.
Colaboraciones
y asociacionesNuestra fortaleza en SafelyHQ reside en nuestras asociaciones. En colaboración con los consumidores, las agencias de salud, los gobiernos locales, las ONG y las organizaciones comunitarias, amplificamos el impacto de cada informe. Estas alianzas no solo mejoran la confiabilidad de nuestros datos, sino que también garantizan respuestas rápidas y coordinadas a los problemas de la comunidad. Juntos, estamos construyendo comunidades resilientes equipadas para enfrentar los desafíos de seguridad modernos.
Empoderar a las comunidades: el impacto de sus informes en SafelyHQ
Diariamente se comparten cientos de informes sobre temas de actualidad como la calidad del agua, la confiabilidad de la energía, las alertas de fraude y más. Los informes y las notificaciones, por un lado, sensibilizan a los miembros de la comunidad y, por otro, permiten a las agencias y a la industria responder rápidamente a cualquier problema emergente. Consulte nuestra página de noticias aquí para ver los informes e incidentes destacados.
En SafelyHQ, entendemos el poder de la vigilancia comunitaria para salvaguardar la salud y la seguridad públicas. Cada informe que realices contribuye a aumentar la conciencia de la comunidad, ya que ayuda a otras personas a mantenerse informadas sobre los posibles riesgos y los problemas emergentes en su entorno. Desde alertar a los vecinos sobre un corte de energía local hasta compartir actualizaciones sobre problemas de salud pública, sus contribuciones desempeñan un papel crucial en el fomento de una comunidad proactiva, receptiva y resiliente. Al aprovechar los conocimientos colectivos de las personas, SafelyHQ no solo proporciona datos en tiempo real para las preocupaciones inmediatas, sino que también ayuda a crear estrategias a largo plazo para la seguridad y el bienestar públicos. Su voz, combinada con el poder de nuestra comunidad, puede conducir a cambios significativos y garantizar un entorno más seguro para todos.
Compromiso con la confianza y la precisión
En SafelyHQ, la confianza es más que un principio; es nuestra base. Entendemos la importancia de una información precisa y transparente para garantizar la seguridad de la comunidad. Nuestro compromiso abarca todas las facetas de nuestra plataforma e incluye un proceso de verificación de datos adecuado que cumpla con los más altos estándares de precisión
y confiabilidad.- Enfoque dual para la recopilación de información
- Envíos generados por los usuarios: en el corazón de SafelyHQ son las contribuciones de los miembros de nuestra comunidad. Cada envío de los usuarios se revisa cuidadosamente para garantizar que proporcione información real y procesable para la seguridad de la comunidad .
- Actualizaciones impulsadas por la investigación: para complementar los envíos de nuestros usuarios, escaneamos, investigamos y presentamos activamente los avisos y retiros reglamentarios locales y nacionales. Nuestro equipo y nuestra tecnología recopilan y verifican diligentemente estas actualizaciones oficiales, proporcionando una visión integral de los avances relacionados con la seguridad .
Entendemos la sensibilidad de la información que manejamos. Nuestra estricta política de privacidad garantiza que los datos que se comparten con nosotros se gestionan con el máximo cuidado y confidencialidad. Su confianza es primordial y nos comprometemos a ser una fuente confiable de información para nuestra comunidad.
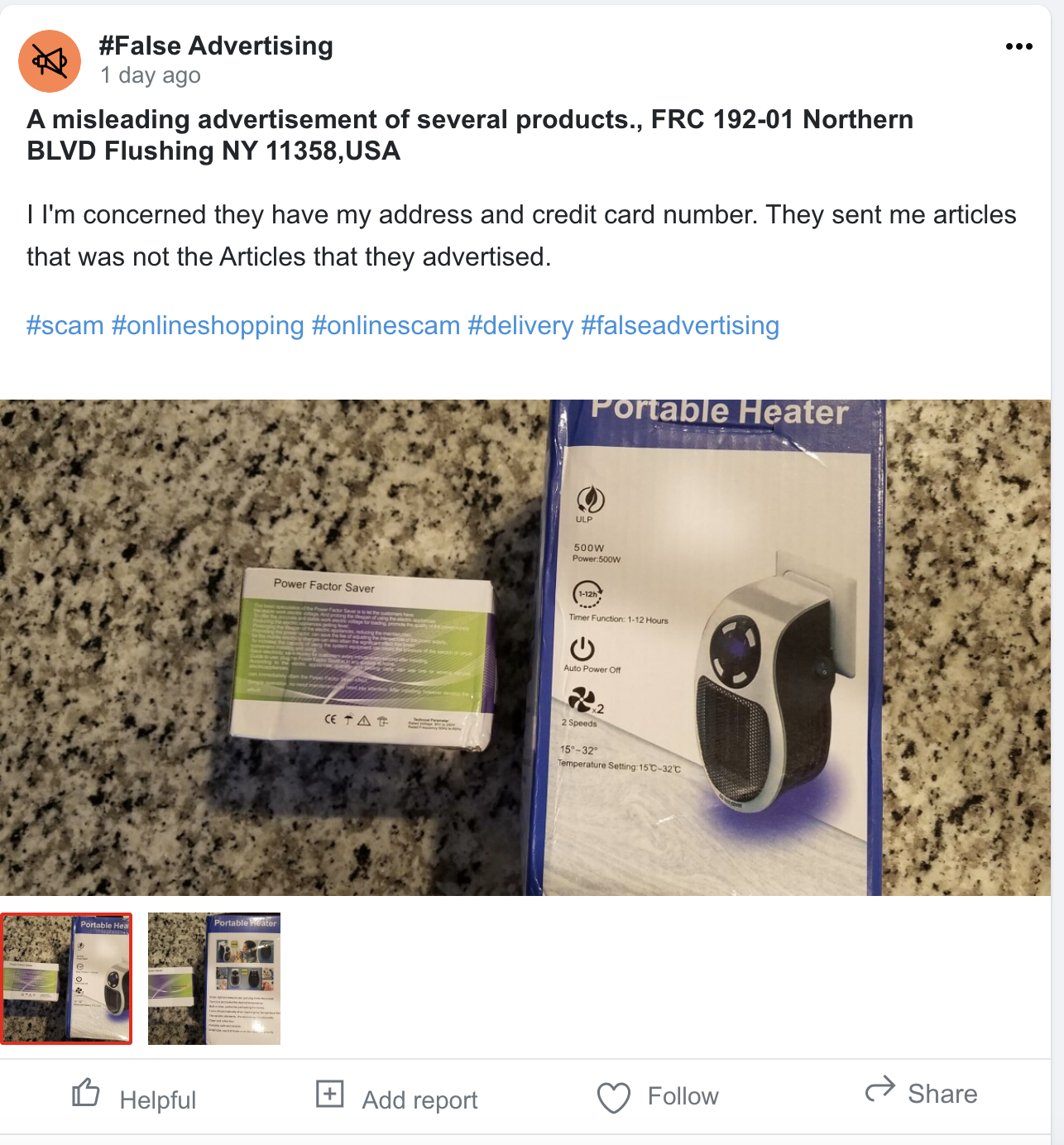
IwasPoisoned.com en los medios
- NY Post: Destaca el papel crucial de SafelyHQ a la hora de identificar y denunciar los peligros para la salud en las golosinas para mascotas, centrándose especialmente en el aumento de los informes de enfermedades y muertes relacionadas con los masticables para perros DreamBone, y haciendo hincapié en el impacto de los datos de colaboración colectiva a la hora de investigaciones realizadas por autoridades como la FDA.
- NY Post: Cubre la investigación de SafelyHQ sobre los casos generalizados de recepción de paquetes vacíos y no solicitados en los EE. UU., lo que sugiere un enlace a estafas «engañosas» por parte de vendedores de Amazon y pone de relieve los problemas de privacidad de los datos.
- NY Post: Habla sobre el papel de SafelyHQ a la hora de descubrir importantes retrasos y pérdidas de paquetes en las instalaciones de Teterboro del USPS, y demuestra el impacto de los informes de riesgo impulsados por la comunidad a la hora de identificar y abordar problemas operativos a gran escala.
Su papel en la seguridad de la comunidad
En SafelyHQ, la participación de la comunidad es vital. Lo alentamos a que participe activamente denunciando problemas, compartiendo ideas y siguiendo las actualizaciones. Su participación no solo contribuye a una conciencia más amplia, sino que también impulsa un cambio significativo. Únase a nuestros foros, participe en las discusiones y sea una parte integral parte de nuestra comunidad preocupada por la seguridad
.
Conéctese con nosotros
¿Tiene preguntas o necesita ayuda?
Ponte en contacto con nosotros en support@safelyhq.com
Preguntas frecuentes
- P: ¿Cómo puedo denunciar un problema?
- Simplemente visita nuestra página «Reportar un problema» y sigue los sencillos pasos para enviar tu informe.
- P: ¿Mi información personal se mantiene confidencial?
- Absolutamente. Proteger su privacidad es nuestra máxima prioridad. Manejamos todos los datos de acuerdo con nuestra política de privacidad.
- P: ¿Puedo hacer un seguimiento del estado de mi informe?
- Sí, puedes seguir las actualizaciones de tu informe y los problemas actuales en nuestro sitio web.
- P: ¿Qué servicios ofrece SafelyHQ?
- Plataforma de crowdsourcing para informes de consumidores sobre temas de salud y seguridad de la comunidad
- Escaneos de redes sociales, sitios de noticias, páginas de condados/ciudades en busca de alertas e informes relacionados
- Actualizaciones de estado en tiempo real sobre la energía, el agua, los brotes y las estafas que afectan a las áreas
- Organización basada en la ubicación por región y hashtag para facilitar la búsqueda
- Notificaciones de alerta a la industria y al gobierno sobre temas emergentes
- Análisis de los problemas actuales y los puntos problemáticos para respaldar las soluciones
- P: ¿Qué valores defiende SafelyHQ?
- Empoderamiento de los consumidores mediante el intercambio de experiencias
- Compromiso con la autenticidad e integridad de los informes de colaboración colectiva
- Presentación objetiva de los datos disponibles públicamente junto con los informes de los consumidores
- Creencia en la conciencia y la responsabilidad impulsadas por la comunidad
Dé el primer paso hacia la seguridad de la comunidad
¿Estás listo para marcar la diferencia? Empieza por informar de un problema o suscribirte a nuestras actualizaciones. Su voz es importante para dar forma a una comunidad más segura e informada. Juntos, tomemos medidas proactivas hacia la seguridad y la conciencia. Reporta un problema aquí. Suscríbase para recibir actualizaciones aquí.
Acerca del fundador

Patrick Quade, fundador y director ejecutivo de IWP Health Inc., supervisa una variedad de plataformas, incluidas SafelyHQ.com, IWasPoisoned.com, Partner.safelyHQ.com y Dinesafe.com. Con una base sólida en el análisis de datos y los sistemas financieros de su época en Morgan Stanley, Patrick navega hábilmente por los ámbitos del crowdsourcing en tiempo real, la gestión de datos y la detección de riesgos en la informática de la salud pública. Su experiencia, perfeccionada durante más de una década, lo posiciona como líder en el uso de datos y tecnología para la seguridad y la salud públicas. Bajo su dirección, estas plataformas han crecido no solo para monitorear los riesgos de los consumidores, especialmente en la industria alimentaria, sino también para proporcionar soluciones B2B con información valiosa de diversas fuentes de datos. El compromiso de Patrick con la salud pública se pone aún más de manifiesto al utilizar el aprendizaje automático avanzado para el análisis de datos, lo que ayuda a la identificación temprana de los riesgos y a la optimización operativa.
Patrick, un distinguido orador, se ha presentado en más de 50 eventos en los EE. UU. y en todo el mundo sobre alimentos, seguridad y salud ambiental, incluida la conferencia de la Asociación Internacional para la Protección de los Alimentos, los eventos de la FDA, las conferencias estatales sobre salud ambiental y las conferencias educativas regionales. Vea todas sus participaciones en eventos aquí. Además, es autor de un artículo revisado por pares en JMIR Public Health & Surveillance y ha aparecido en importantes publicaciones como el New York Times, el Washington Post, USA Today y el Wall Street Journal por sus contribuciones a la detección de brotes y
la mejora de la salud pública.
SafelyHQ es una subsidiaria de IWP Health Inc.
