Recall notice
Inyección de Clorhidrato de Ropivacaína retirada debido a Fibra Inerte, USA
hace 8 meses •source fda.gov
United States
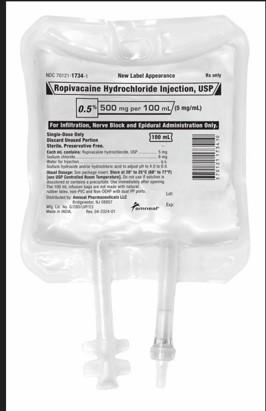
Amneal Pharmaceutical LLC está retirando dos lotes de Inyección de Clorhidrato de Ropivacaína, USP, 500mg/100mL, bolsas de infusión a nivel hospitalario/usuario ya que los productos pueden contener una fibra inerte identificada como fibras de polipropileno de la bolsa IV. El producto retirado fue distribuido a nivel nacional a mayoristas/distribuidores únicamente entre las fechas del 23/04/2024 al 08/11/2024.Declaración de Riesgo: La introducción de partículas de polipropileno en el espacio epidural (o administración inadvertida en el espacio intratecal) puede resultar en una variedad de eventos adversos. Existe una probabilidad razonable de que la materia particulada en el espacio epidural pueda causar un proceso inflamatorio epidural hasta meningitis o potencialmente dañar la médula espinal. Administrada por vía intratecal, la materia particulada podría resultar en inflamación, hidrocefalia (agua en el cerebro), lo que podría llevar a embolización y daño orgánico.
El producto está indicado para la producción de anestesia local o regional para cirugía y/o manejo del dolor agudo y está empaquetado en bolsas IV de dosis única de 12x100mL (NDC 70121-17343). Los productos afectados de Inyección de Clorhidrato de Ropivacaína, USP, 500mg/100mL, son el Lote AL240003 (exp 01/2026) y el Lote AL240004 (exp 01/2026). Ningún otro lote de Inyección de Clorhidrato de Ropivacaína, USP está impactado.
Amneal está notificando a sus clientes por UPS y está organizando el retorno de todos los productos retirados. Se solicita a los mayoristas/distribuidores que notifiquen a sus clientes hospitalarios/usuarios sobre el retiro y proporcionen instrucciones para contactar a Amneal para el retorno de los productos retirados a Amneal.
Fuente: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/amneal-pharmaceutical-llc-issues-nationwide-recall-ropivacaine-hydrochloride-injection-usp
Comentarios
Comentario