Recall notice
Injection de Chlorhydrate de Ropivacaïne rappelée en raison de Fibre Inerte, USA
il y a 8 mois •source fda.gov
United States
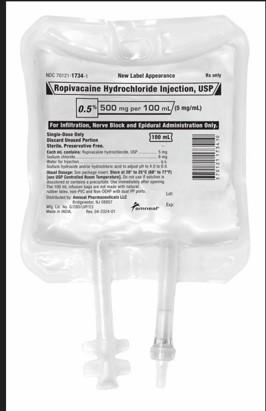
Amneal Pharmaceutical LLC rappelle deux lots d'Injection de Chlorhydrate de Ropivacaïne, USP, 500mg/100mL, poches de perfusion au niveau hospitalier/utilisateur car les produits peuvent contenir une fibre inerte identifiée comme des fibres de polypropylène provenant de la poche IV. Le produit rappelé a été distribué à l'échelle nationale aux grossistes/distributeurs uniquement entre les dates du 23/04/2024 au 08/11/2024.Déclaration de Risque : L'introduction de particules de polypropylène dans l'espace épidural (ou administration par inadvertance dans l'espace intrathécal) peut entraîner une variété d'événements indésirables. Il existe une probabilité raisonnable que les particules dans l'espace épidural puissent causer un processus inflammatoire épidural jusqu'à la méningite ou potentiellement endommager la moelle épinière. Administrées par voie intrathécale, les particules pourraient entraîner une inflammation, une hydrocéphalie (eau dans le cerveau), ce qui pourrait conduire à une embolisation et des dommages aux organes.
Le produit est indiqué pour la production d'anesthésie locale ou régionale pour la chirurgie et/ou la gestion de la douleur aiguë et est conditionné dans des poches IV à dose unique de 12x100mL (NDC 70121-17343). Les produits d'Injection de Chlorhydrate de Ropivacaïne, USP, 500mg/100mL affectés sont le Lot AL240003 (exp 01/2026) et le Lot AL240004 (exp 01/2026). Aucun autre lot d'Injection de Chlorhydrate de Ropivacaïne, USP n'est impacté.
Amneal notifie ses clients par UPS et organise le retour de tous les produits rappelés. Les grossistes/distributeurs sont priés de notifier leurs clients hospitaliers/utilisateurs du rappel et de fournir des instructions pour contacter Amneal pour le retour des produits rappelés à Amneal.
Source : www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/amneal-pharmaceutical-llc-issues-nationwide-recall-ropivacaine-hydrochloride-injection-usp
Commentaires
Commentaire