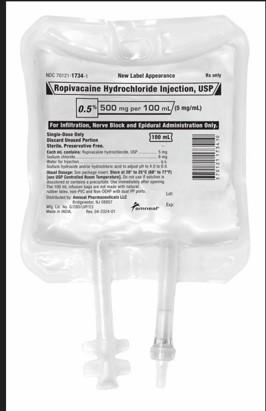
Recall notice
Ropivacain-Hydrochlorid-Injektion wegen inerter Faser zurückgerufen, USA
vor 8 Monaten •source fda.gov
United States
Amneal Pharmaceutical LLC ruft zwei Chargen von Ropivacain-Hydrochlorid-Injektion, USP, 500mg/100mL, Infusionsbeutel auf Krankenhaus-/Anwenderebene zurück, da die Produkte inerte Fasern enthalten können, die als Polypropylenfasern aus dem IV-Beutel identifiziert wurden. Das zurückgerufene Produkt wurde nur zwischen dem 23.04.2024 und dem 08.11.2024 landesweit an Großhändler/Distributoren vertrieben.Risikoerklärung: Die Einführung von Polypropylen-Partikeln in den Epiduralraum (oder versehentliche Verabreichung in den intrathekalen Raum) kann zu verschiedenen unerwünschten Ereignissen führen. Es besteht eine angemessene Wahrscheinlichkeit, dass Partikelmaterial im Epiduralraum einen epiduralen Entzündungsprozess bis hin zur Meningitis verursachen oder das Rückenmark schädigen könnte. Bei intrathekaler Verabreichung könnte Partikelmaterial zu Entzündungen, Hydrozephalus (Wasser im Gehirn) führen, was zu Embolisation und Organschäden führen könnte.
Das Produkt ist für die Erzeugung lokaler oder regionaler Anästhesie für Operationen und/oder akute Schmerzbehandlung indiziert und wird in 12x100mL Einzeldosis-IV-Beuteln verpackt (NDC 70121-17343). Die betroffenen Ropivacain-Hydrochlorid-Injektionen, USP, 500mg/100mL, sind Charge AL240003 (Ablauf 01/2026) und Charge AL240004 (Ablauf 01/2026). Keine anderen Ropivacain-Hydrochlorid-Injektions-USP-Chargen sind betroffen.
Amneal benachrichtigt seine Kunden per UPS und organisiert die Rückgabe aller zurückgerufenen Produkte. Großhändler/Distributoren werden gebeten, ihre Krankenhaus-/Anwenderkunden über den Rückruf zu informieren und Anweisungen zu geben, Amneal für die Rückgabe der zurückgerufenen Produkte an Amneal zu kontaktieren.
Quelle: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/amneal-pharmaceutical-llc-issues-nationwide-recall-ropivacaine-hydrochloride-injection-usp
Bemerkungen
Kommentar