Über Uns
Mission von SafelyHQ
SafelyHQ wurde gegründet, um das Potenzial gemeinsamer Verbrauchererlebnisse für die Gemeinschaft zu nutzen. Unser Team verfügt über Fachwissen in den Bereichen Crowdsourcing, Datenverifizierung, Analyse und Kommunikation. Diese Plattform basiert auf der Kraft des geteilten Wissens. Wir fassen Verbraucherberichte zu wichtigen Problemen in der Gemeinde zusammen, die von Stromausfällen über Betrugswarnungen bis hin zu Hinweisen zum Kochen von Wasser reichen, und durchsuchen gleichzeitig Online-Quellen nach entsprechenden Hinweisen von lokalen Stellen und Social-Media-Plattformen. Durch die Zentralisierung dieser Echtzeitberichte an einem Ort, sortiert nach Standort und Betreff wie #PowerOutage, #BoilWaterAdvisory oder #Boston, ermöglichen wir es den Gemeinden, auf dem Laufenden zu bleiben und bieten gleichzeitig wichtige Einblicke für die Branche und Behörden. Unsere Verifizierungsprozesse zielen darauf ab, die Echtheit der Berichte sicherzustellen, sodass unsere Plattform einen zuverlässigen Überblick über neu auftretende Probleme bietet. Wir glauben, dass die Entwicklung technologiegestützter Transparenz in großem Maßstab die Gemeinschaften verändern kann, indem Trends frühzeitig erkannt und Problemlösungen beschleunigt werden. Dadurch wird ein neues Maß an Rechenschaftspflicht, Reaktionsfähigkeit und letztlich Sicherheit und Wohlbefinden für alle geschaffen
.So funktioniert es, unser Prozess
- Bei SafelyHQ vereinfachen wir den komplexen Weg von der Problemmeldung bis zur Lösung. Es beginnt, wenn Sie als Verbraucher ein Anliegen auf SafelyHQ melden. SafelyHQ greift auch direkt auf Nachrichtenberichte, Regierungsseiten, soziale Medien und Community-Websites zurück, um auf Bedenken hinzuweisen.
- Jeder Verbraucherbericht auf SafelyHQ erhält sowohl eine menschliche Überprüfung als auch eine technische Backend-Überprüfung. Diese Bewertungen dienen dazu, böswillige oder unauthentische Berichte zu entfernen. Der Missbrauch oder die böswillige Nutzung der Website durch Benutzer verstößt ebenfalls gegen unsere Nutzungsbedingungen. Wir verpflichten uns, so gut wie möglich sicherzustellen, dass jeder Bericht eine authentische Beobachtung einer realen Person darstellt.
- Während dieses gesamten Prozesses, vom Bericht bis zur öffentlichen Veröffentlichung, sorgen wir für Transparenz und halten unsere Community auf dem Laufenden, um eine proaktive und informierte Öffentlichkeit zu fördern.
Kollaborationen
und PartnerschaftenUnsere Stärke bei SafelyHQ liegt in unseren Partnerschaften. In Zusammenarbeit mit Verbrauchern, Gesundheitsbehörden, Kommunalverwaltungen, NGOs und Gemeindeorganisationen verstärken wir die Wirkung jedes Berichts. Diese Allianzen erhöhen nicht nur die Zuverlässigkeit unserer Daten, sondern sorgen auch für schnelle, koordinierte Reaktionen auf Probleme der Gemeinschaft. Gemeinsam bauen wir widerstandsfähige Gemeinden auf, die für moderne Sicherheitsherausforderungen gerüstet sind.
Stärkung der Gemeinschaften: Die Wirkung Ihrer Berichte bei SafelyHQ
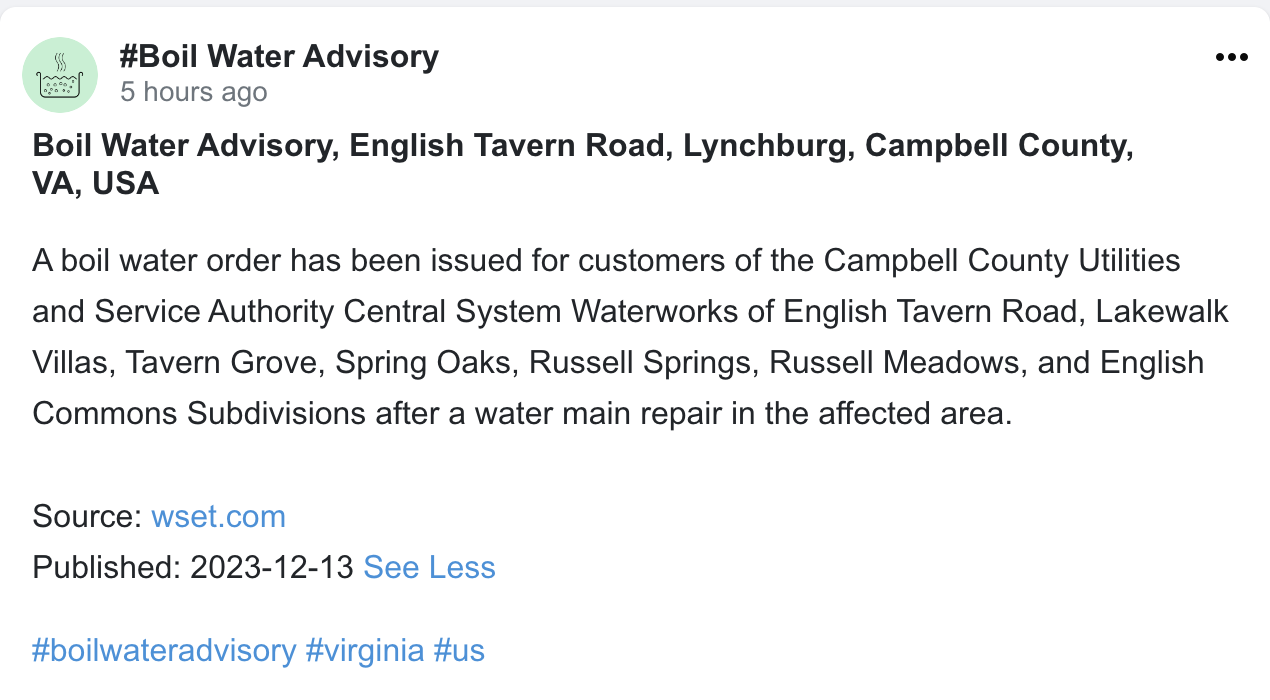
Hunderte von Berichten werden täglich zu aktuellen Themen wie Wasserqualität, Zuverlässigkeit der Stromversorgung, Betrugswarnungen und mehr veröffentlicht. Berichte und Benachrichtigungen sensibilisieren zum einen die Mitglieder der Gemeinschaft und zum anderen ermöglichen es Behörden und der Industrie, schnell auf neu auftretende Probleme zu reagieren. Auf unserer Nachrichtenseite finden Sie hier die wichtigsten Berichte und Vorfälle.
Bei SafelyHQ wissen wir, wie wichtig die Wachsamkeit der Gemeinschaft beim Schutz der öffentlichen Gesundheit und Sicherheit ist. Jeder Bericht, den Sie erstellen, trägt zu einem größeren Bewusstsein in der Gemeinschaft bei und hilft anderen, über potenzielle Risiken und neue Probleme in ihrer Umgebung auf dem Laufenden zu bleiben. Von der Benachrichtigung der Nachbarn über einen lokalen Stromausfall bis hin zur Weitergabe von Updates zu Problemen der öffentlichen Gesundheit — Ihre Beiträge spielen eine entscheidende Rolle bei der Förderung einer proaktiven, reaktionsschnellen und widerstandsfähigen Gemeinschaft. SafelyHQ nutzt die kollektiven Erkenntnisse von Einzelpersonen und liefert nicht nur Echtzeitdaten für unmittelbare Probleme, sondern hilft auch bei der Entwicklung langfristiger Strategien für die öffentliche Sicherheit und das Wohlbefinden. Ihre Stimme, kombiniert mit der Kraft unserer Community, kann zu bedeutsamen Veränderungen führen und eine sicherere Umgebung für alle gewährleisten.
Verpflichtung zu Vertrauen und Genauigkeit
Bei SafelyHQ ist Vertrauen mehr als ein Prinzip; es ist unsere Grundlage. Wir wissen, wie wichtig genaue und transparente Informationen für die Sicherheit der Gemeinschaft sind. Unser Engagement erstreckt sich auf alle Facetten unserer Plattform und umfasst einen ordnungsgemäßen Datenüberprüfungsprozess, der die höchsten Genauigkeits- und Zuverlässigkeitsstandards
einhält.- Doppelter Ansatz zur Informationsbeschaffung
- Nutzergenerierte Beiträge: Das Herzstück von SafelyHQ sind die Beiträge unserer Community-Mitglieder. Jede Einreichung von Nutzern wird sorgfältig geprüft, um sicherzustellen, dass sie echte, umsetzbare Erkenntnisse für die Sicherheit der Community liefert .
- Forschungsorientierte Updates: In Ergänzung zu unseren Nutzerbeiträgen scannen, recherchieren und präsentieren wir aktiv lokale und nationale behördliche Hinweise und Rückrufe. Unser Team und unsere Technologie sammeln und überprüfen diese offiziellen Updates gewissenhaft und bieten so einen umfassenden Überblick über sicherheitsrelevante Entwicklungen.
Wir verstehen die Sensibilität der Informationen, mit denen wir umgehen. Unsere strenge Datenschutzrichtlinie stellt sicher, dass die mit uns geteilten Daten mit größter Sorgfalt und Vertraulichkeit verwaltet werden. Ihr Vertrauen ist von größter Bedeutung, und wir sind bestrebt, eine zuverlässige Informationsquelle für unsere Community zu sein.
IwasPoisoned.com in den Medien
- NY Post: Hebt die entscheidende Rolle von SafelyHQ bei der Identifizierung und Meldung von Gesundheitsgefahren in Leckerlis für Haustiere hervor, wobei der Schwerpunkt insbesondere auf die zunehmenden Berichte über Krankheiten und Todesfälle im Zusammenhang mit DreamBone-Hundekauen liegt, und betont die Auswirkungen von Crowdsourcing-Daten bei der Aufforderung Ermittlungen von Behörden wie der FDA.
- NY Post: berichtet über die Untersuchung von SafelyHQ zu weit verbreiteten Vorfällen, bei denen unaufgefordert leere Pakete in den USA eingegangen sind, und weist auf einen Zusammenhang mit Betrügereien durch Amazon-Anbieter hin und weist auf Datenschutzbedenken hin.
- NY Post: spricht über die Rolle von SafelyHQ bei der Aufdeckung erheblicher Verzögerungen und Paketverluste im Werk von USPS in Teterboro und zeigt, wie sich die gemeindegestützte Risikoberichterstattung auf die Identifizierung und Behebung großer Betriebsprobleme auswirkt.
Ihre Rolle bei der Sicherheit in der Gemeinschaft
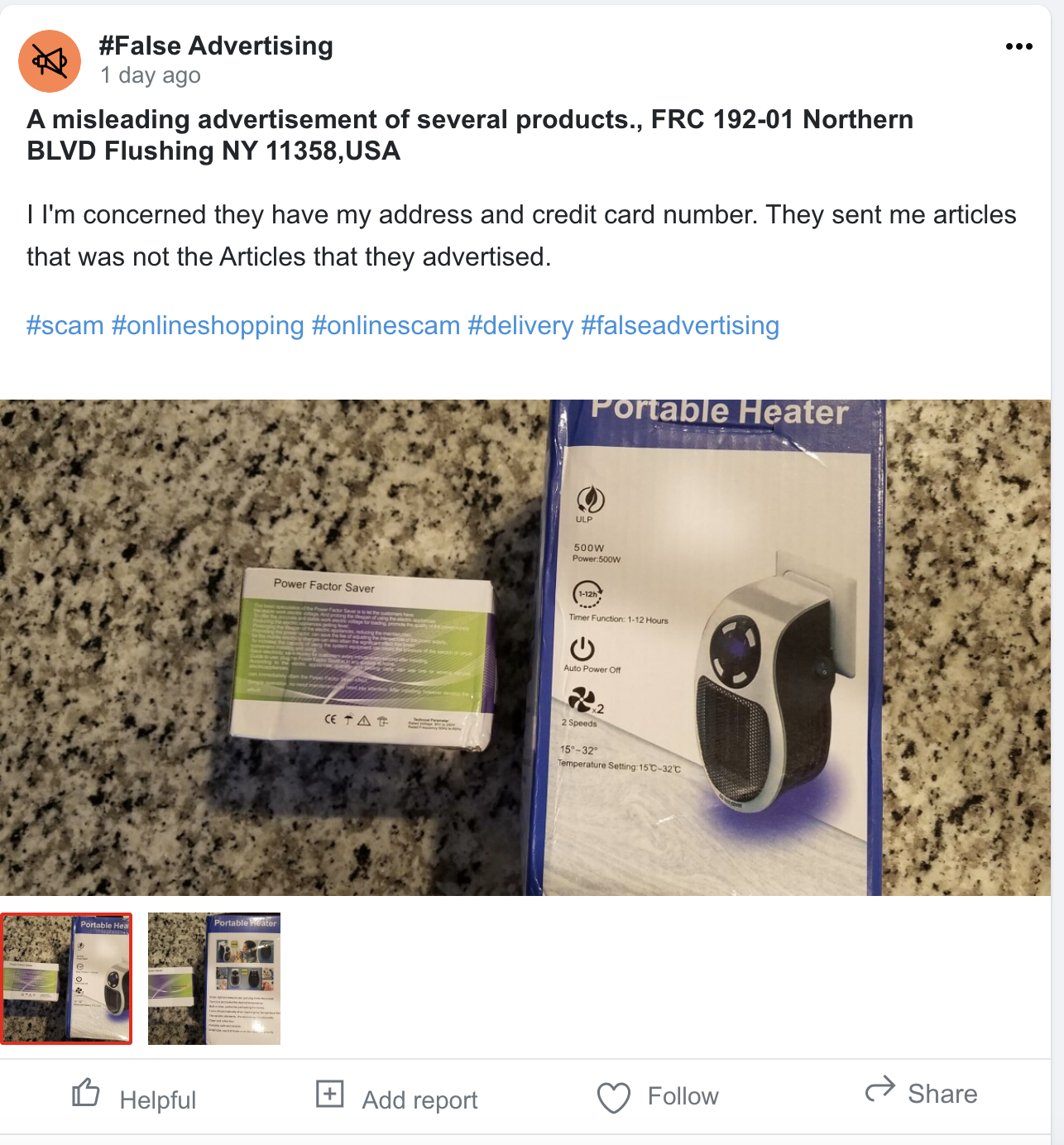
Bei SafelyHQ ist das Engagement der Gemeinschaft von entscheidender Bedeutung. Wir empfehlen Ihnen, aktiv teilzunehmen, indem Sie Probleme melden, Erkenntnisse teilen und Updates verfolgen. Ihr Engagement trägt nicht nur zu einem breiteren Bewusstsein bei, sondern treibt auch bedeutende Veränderungen voran. Tritt unseren Foren bei, nimm an Diskussionen teil und sei ein integraler Bestandteil Teil unserer sicherheitsbewussten Community
.
Verbinde dich mit uns
Haben Sie Fragen oder benötigen Sie Hilfe?
Kontaktiere uns unter support@safelyhq.com
Häufig gestellte Fragen
- F: Wie kann ich ein Problem melden?
- Besuchen Sie einfach unsere Seite „Ein Problem melden“ und folgen Sie den einfachen Schritten, um Ihren Bericht einzureichen.
- F: Werden meine persönlichen Daten vertraulich behandelt?
- Absolut. Der Schutz Ihrer Privatsphäre hat für uns oberste Priorität. Wir behandeln alle Daten gemäß unserer Datenschutzrichtlinie.
- F: Kann ich den Status meines Berichts verfolgen?
- Ja, Sie können Aktualisierungen Ihres Berichts und aktuelle Probleme auf unserer Website verfolgen.
- F: Welche Dienstleistungen bietet SafelyHQ an?
- Crowdsourcing-Plattform für Verbraucherberichte zu Gesundheits- und Sicherheitsfragen der Gemeinschaft
- Scans von sozialen Netzwerken, Nachrichtenseiten, Landkreis-/Stadtseiten nach entsprechenden Warnungen und Berichten
- Statusaktualisierungen in Echtzeit zu Strom, Wasser, Ausbrüchen und Betrügereien in Gebieten
- Standortbasierte Organisation nach Region und Hashtag für eine einfache Suche
- Warnmeldungen an Industrie und Regierung bei neu auftretenden Problemen
- Analyse aktueller Probleme und Problembereiche zur Unterstützung von Lösungen
- F: Zu welchen Werten steht SafelyHQ?
- Stärkung der Verbraucher durch Erfahrungsaustausch
- Verpflichtung zur Authentizität und Integrität von Crowdsourcing-Berichten
- Objektive Präsentation öffentlich verfügbarer Daten zusammen mit Verbraucherberichten
- Glaube an gemeinschaftsorientiertes Bewusstsein und Rechenschaftspflicht
Machen Sie den ersten Schritt zur Sicherheit der Gemeinschaft
Bereit, etwas zu bewegen? Melden Sie zunächst ein Problem oder melden Sie sich für unsere Updates an. Ihre Stimme ist wichtig, um eine sicherere und besser informierte Gemeinschaft zu gestalten. Lassen Sie uns gemeinsam proaktive Schritte in Richtung Sicherheit und Sensibilisierung unternehmen. Melde hier ein Problem. Abonnieren Sie hier Updates.
Über den Gründer

Patrick Quade, der Gründer und CEO von IWP Health Inc., beaufsichtigt eine Reihe von Plattformen, darunter SafelyHQ.com, IwasPoisoned.com, Partner.SafelyHQ.com und Dinesafe.com. Mit einer soliden Grundlage in der Datenanalyse Patrick und die Finanzsysteme aus seiner Zeit bei Morgan Stanley, navigiert gekonnt durch die Bereiche Echtzeit-Crowdsourcing, Datenmanagement und Risikoerkennung in der öffentlichen Gesundheitsinformatik. Sein Fachwissen, das er über ein Jahrzehnt gesammelt hat, macht ihn zu einem führenden Unternehmen in der Nutzung von Daten und Technologien für die öffentliche Sicherheit und Gesundheit. Unter seiner Leitung wurden diese Plattformen erweitert, um nicht nur Verbraucherrisiken, insbesondere in der Lebensmittelindustrie, zu überwachen, sondern auch B2B-Lösungen mit wertvollen Erkenntnissen aus verschiedenen Datenquellen bereitzustellen. Patricks Engagement für die öffentliche Gesundheit zeigt sich auch darin, dass er fortschrittliches maschinelles Lernen für die Datenanalyse einsetzt, das bei der frühzeitigen Risikoidentifikation und Betriebsoptimierung hilft
.Patrick, ein angesehener Redner, hat auf über 50 Veranstaltungen in den USA und weltweit zu den Themen Lebensmittel, Sicherheit und Umweltgesundheit Vorträge gehalten, darunter auf der International Association for Food Protection Conference, FDA-Veranstaltungen, staatlichen Umweltgesundheitskonferenzen und regionalen Bildungskonferenzen. Alle seine Veranstaltungsteilnahmen finden Sie hier. Darüber hinaus hat er einen von Experten begutachteten Artikel in JMIR Public Health & Surveillance verfasst und wurde in wichtigen Publikationen wie der New York Times, der Washington Post, USA Today und dem Wall Street Journal für seine Beiträge zur Erkennung von Ausbrüchen und zur Verbesserung der öffentlichen Gesundheit vorgestellt
.
SafelyHQ ist eine Tochtergesellschaft von IWP Health Inc.
