Unbestelltes Paket von Honeas Orixtty, North Wales, PA 19454, USA
vor 1 Tag •reported by user-bpvr5628 • einzelheiten
Betrug, Bremen, GA, USA
vor 3 Tagen •reported by user-bnmb2927 • einzelheiten
Ich habe Grassamen von Facebook bestellt, Lakeland, Georgia 31635, USA
vor 3 Tagen •reported by user-wcjmf236 • einzelheiten
Ein leeres Paket von einer Firma, bei der ich nicht bestellt habe, Chicago, IL, USA
vor 1 Woche •reported by user-kctpp117 • einzelheiten
Als ich es öffnete, war es leer.
Ich habe das Unternehmen gegoogelt und bin auf viele „Betrugsberichte“ gestoßen. Ich kann mich nicht erinnern, bei dieser Firma bestellt zu haben.
Recall notice
Alkaloid-Kautabletten - White Vein zurückgerufen aufgrund erhöhter 7-OH-Werte, USA
vor 2 Wochen •source fda.gov • einzelheiten
Dream Bone, Tampa, FL, USA
vor 2 Wochen •reported by user-qbzb4927 • einzelheiten
Wasserausfall, Raymond Rd, Mayslick, KY, USA
vor 3 Wochen •reported by user-cvvwb984 • einzelheiten
Shinerya.com Betrug, Tahlequah, OK, USA
vor 3 Wochen •reported by user-mjjyc942 • einzelheiten
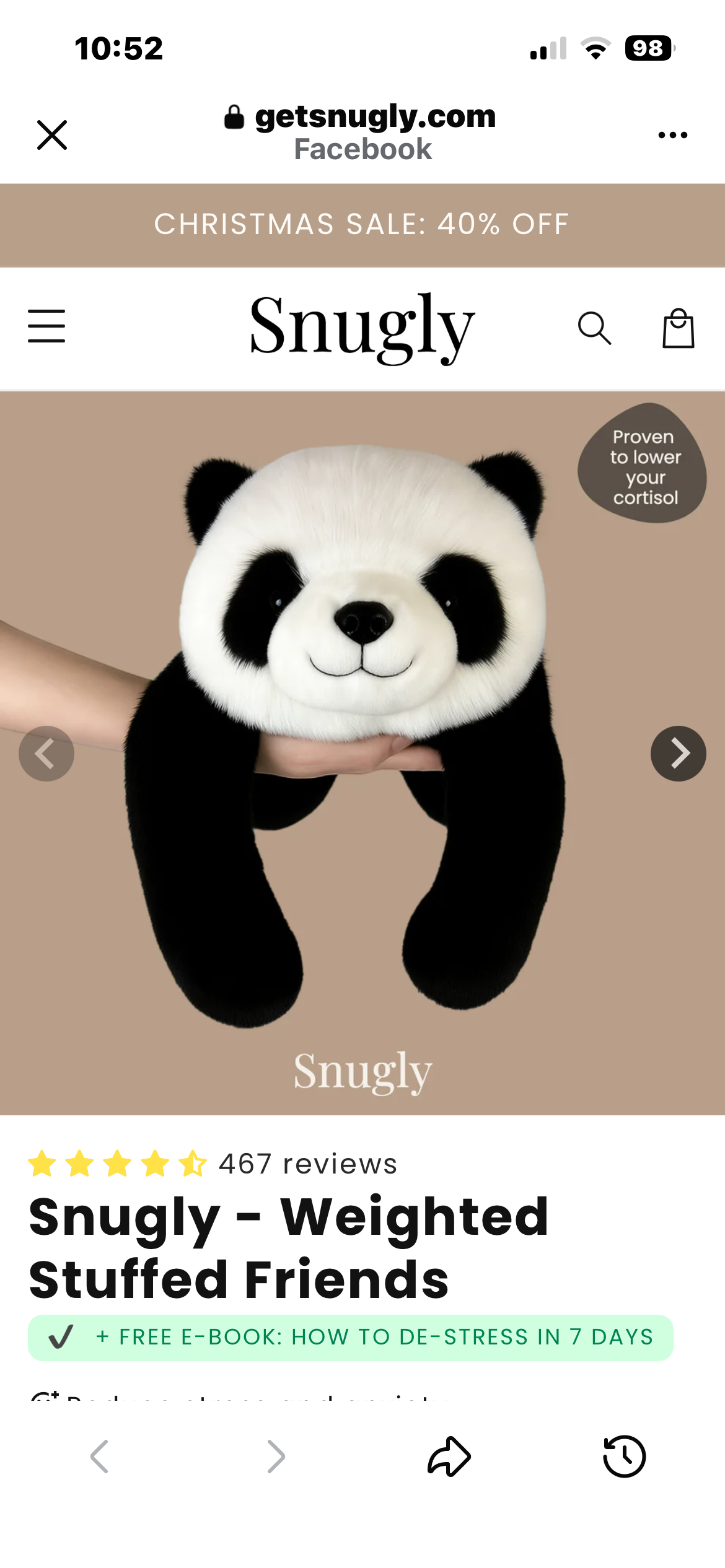
Betrug Koala Snugly, Las Vegas, NV, USA
vor 2 Monaten •reported by user-vdxkg271 • einzelheiten
Angeblich in die USA, es stellte sich heraus, dass es sich um China handelte.
Betrügerische gefälschte USPS-Etiketten Name: Honeas Orxtty, 290 Duffy Ave, Hicksville, NY 11801, USA
vor 3 Monaten •reported by user-vbnw3125 • einzelheiten
E-Mail-Benachrichtigungen kamen von totaladdly