CRONUS PHARMA LLC代表印度海得拉巴的Cronus Pharma Specialties宣布自愿召回,涉及一批包含两个不同批次的产品:Dexased™(Aspen)和Dexmedvet™(Cronus Pharma LLC)。两种产品均含盐酸右美托咪定注射液 0.5 mg/mL,这是美国的一种处方产品,用作狗和猫的镇静剂和镇痛剂,用于促进临床检查、临床手术、小型外科手术和小型牙科手术。该产品还可用作狗和猫的全身麻醉的预麻醉剂。
此次召回是作为预防措施进行的,因为在溶液中观察到可见的颗粒物(被描述为晶状颗粒、白色漂浮物或沉淀物)。
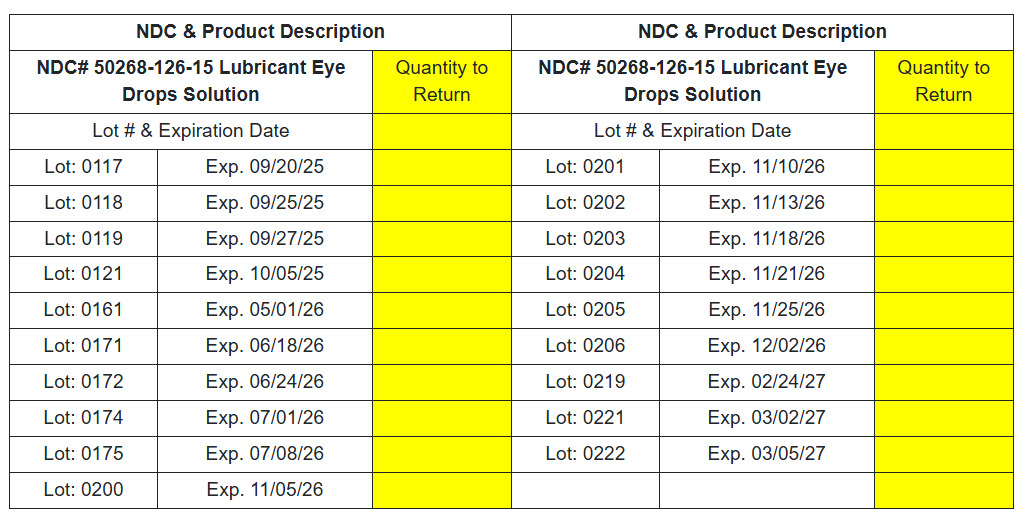
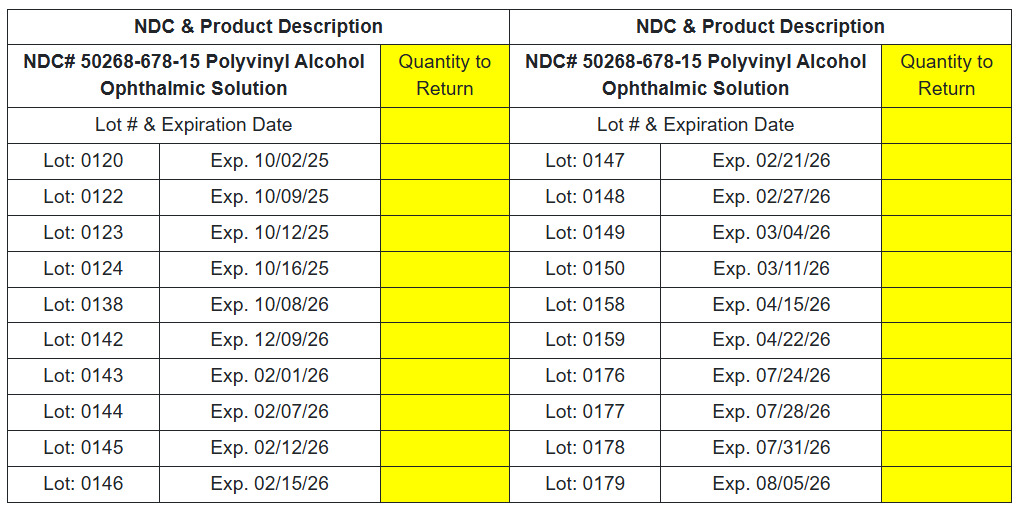
在目视检查以下批次的对照样本时,观察到晶状颗粒/白色物质漂浮/沉淀物:
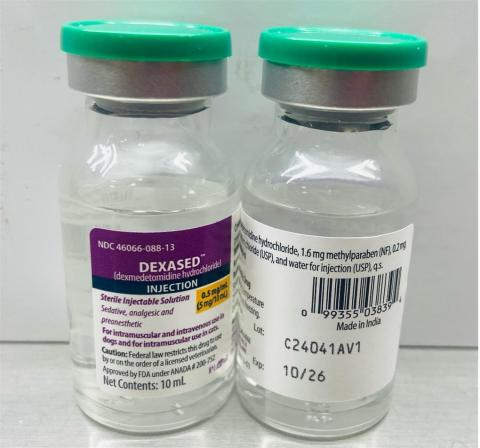
-Dexased™:盐酸右美托咪定注射液 0.5mg/ml(Aspen),NDC 编号:46066-088-13,批次编号:C24041AV1,Mfg。日期:2024 年 11 月,到期日期:2026 年 10 月。
-发行日期:2024 年 12 月至 2025 年 4 月 4 日
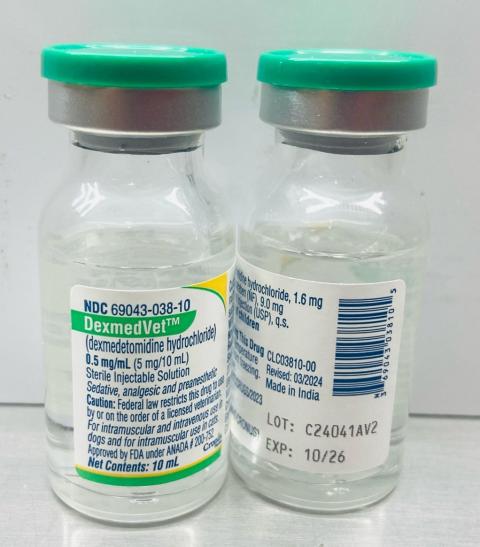
-dexmedVet™:盐酸右美托咪定注射液 0.5mg/ml(Cronus Pharma LLC),NDC 编号:69043-038-10,批次号:C24041AV2,Mfg。日期:2024 年 11 月,到期日期:2026 年 10 月。
-分发日期:2025 年 3 月至 2025 年…
更多