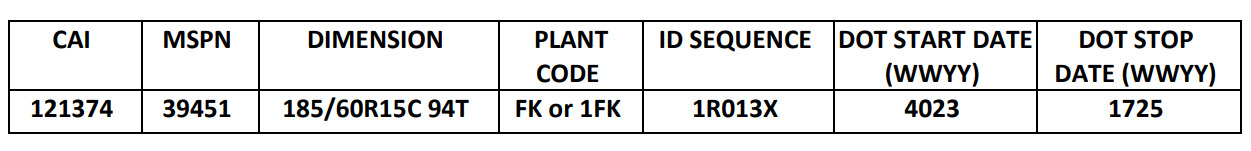
召回的轮胎是:
-由尺寸 185/60R15C 94T 识别
-DOT 的生产日期代码介于 4023 年和 1725 年之间。
-特定的工厂代码是 FK 或 1FK
-ID 序列为 1R013X。
该问题是通过内部测试发现的,召回于2025年6月30日启动。由于事故风险可能增加,因此被归类为安全召回。
如果您或您所爱的人受到伤害或出现任何症状,请务必报告。报告可以帮助及早发现和解决疫情,防止他人受到伤害,并实现更好的监测。如果症状持续存在,请就医。
来源:cdn.bfldr.com/U447IH35/as/bzfnwhrj5ccb9swnfw3pngh/FINALAgilisCrossClimateConsumerLetterUS-EN