Recall notice
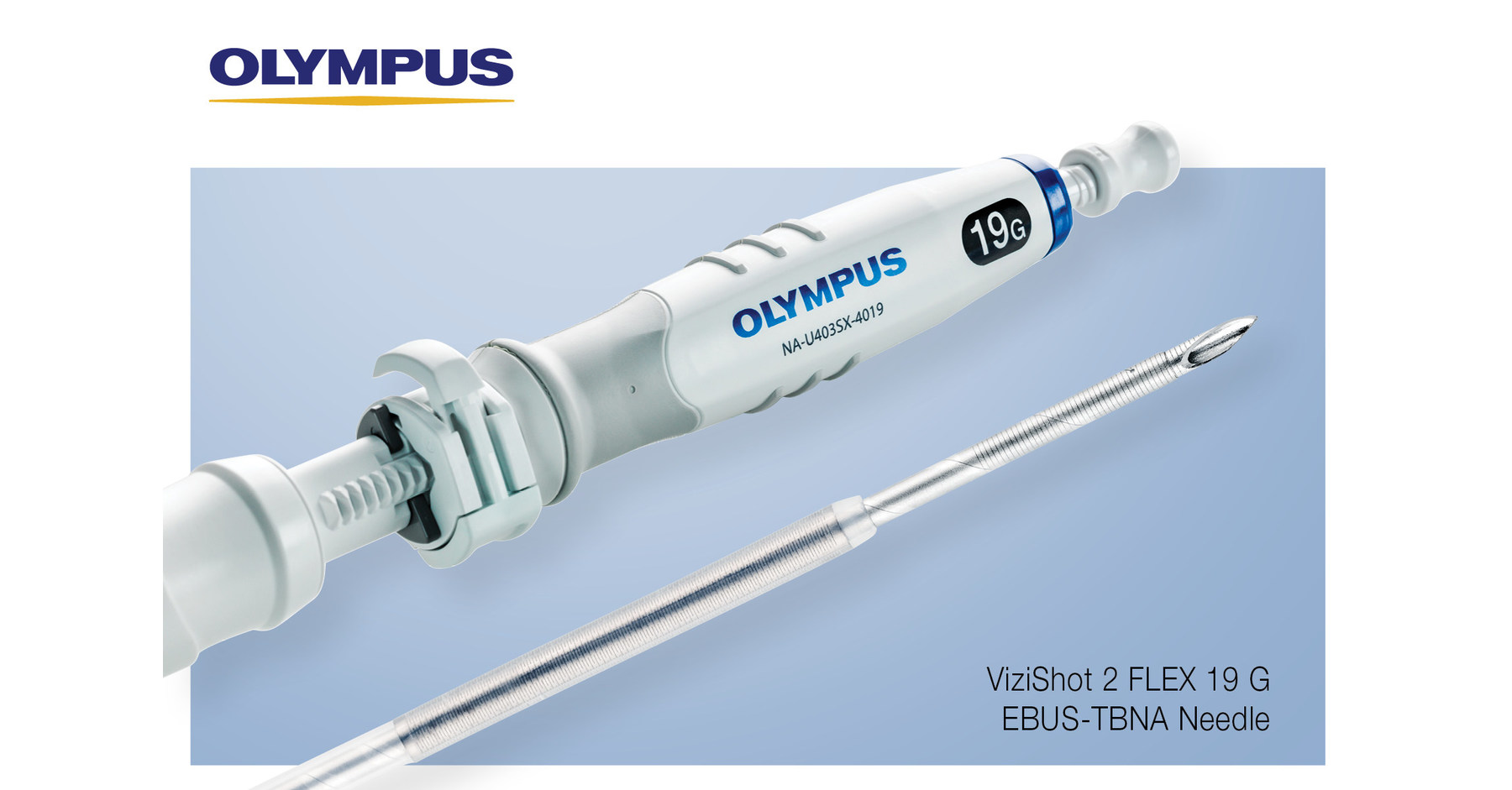
ViziShot 2 FLEX (19G) EBUS-TBNA 针头因缺陷被召回, USA
1个月前 •source fda.gov
United States
奥林巴斯公司宣布扩大之前针对ViziShot 2 FLEX (19G) EBUS-TBNA针头("ViziShot 2 FLEX")的全球医疗器械召回行动,此前收到并调查了关于器械组件在手术过程中弹出或脱落的投诉。投诉包括患者受伤和一例死亡的不良事件报告。此次扩大行动包括所有批次的ViziShot 2 FLEX针头,并取代了2025年8月的通知,该通知仅召回了器械的某些批次。受影响的器械在美国分销。ViziShot 2 FLEX组件脱落的潜在后果包括气管支气管树内意外器械组件的风险,可能需要支气管镜提取或手术移除。
自2025年8月通知以来,对投诉的内部调查确定了导致细管组件弹出的其他因素,包括器械热缩材料降解和使用错误,这些因素影响ViziShot 2 FLEX器械的所有批次。密封针头的器械热缩材料可能在临床使用过程中降解,可能导致提取或排出样本困难、液体泄漏、针头部署或收缩受损,或器械组件破损。
指示用户立即停止使用并隔离所有ViziShot 2 FLEX器械。已指示客户按照召回行动通信中提供的说明将受影响的器械退回奥林巴斯。患者安全是我们的首要任务。
24
评论
评论