Recall notice
Se retira del mercado la inyección de clorhidrato de Dexased™ y Dexmedvet™ debido a la presencia de partículas, USA
hace 10 meses •source fda.gov
United States
CRONUS PHARMA LLC, en nombre de Cronus Pharma Specialties, de Hyderabad (India), está emitiendo una retirada voluntaria de un lote compuesto por dos lotes distintos: Dexased™ (Aspen) y Dexmedvet™ (Cronus Pharma LLC). Ambos productos contienen clorhidrato de dexmedetomidina inyectable de 0,5 mg/ml, que es un producto recetado en los Estados Unidos que se usa como sedante y analgésico en perros y gatos para facilitar los exámenes clínicos, los procedimientos clínicos, los procedimientos quirúrgicos menores y los procedimientos dentales menores. Este producto también está indicado para su uso como preanestésico para la anestesia general en perros y gatos.La retirada se lleva a cabo como medida de precaución debido a la presencia de partículas visibles (descritas como partículas cristalinas, materia blanca flotante o precipitados) observadas en la solución.
Durante la inspección visual de las muestras de control para los siguientes lotes, se observaron partículas cristalinas, materia blanca que flotaba o precipitado:
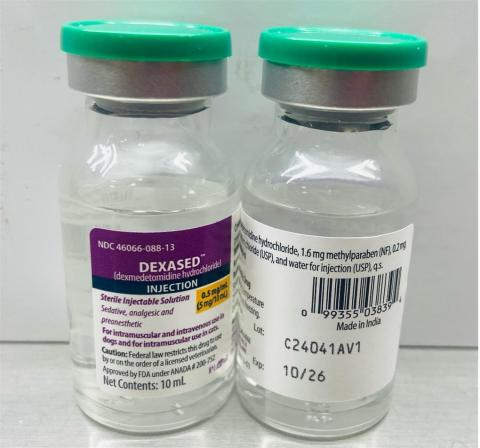
- Dexased™: inyección de clorhidrato de dexmedetomidina 0,5 mg/ml (Aspen), no NDC: 46066-088-13, número de lote: C24041AV1, Mfg. Fecha: nov. 2024, Exp. Fecha: octubre de 2026.
- Fechas de distribución: de diciembre de 2024 al 4 de abril de 2025
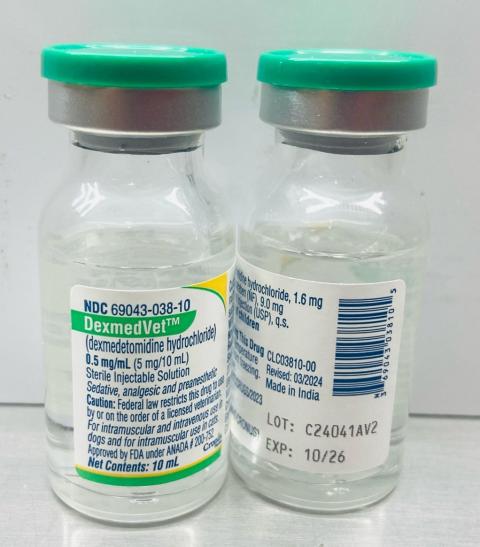
- DexMedVet™: inyección de clorhidrato de dexmedetomidina 0,5 mg/ml (Cronus Pharma LLC), número de NDC: 69043-038-10, número de lote: C24041AV2, Mfg. Fecha: nov. 2024, Exp. Fecha: octubre de 2026.
- Fechas de distribución: de marzo de 2025 al 4 de abril de 2025
El número de lote (LOT) y la fecha de caducidad (EXP) se encuentran en la parte inferior derecha de la etiqueta del frasco.
La administración de un producto inyectable que contenga partículas puede provocar efectos adversos graves. Las posibles complicaciones incluyen la inflamación, el granuloma, la fibrosis y la obstrucción de los vasos sanguíneos del corazón, los pulmones o el cerebro, lo que puede provocar un accidente cerebrovascular o episodios de coágulos sanguíneos potencialmente mortales, incluida la muerte. El riesgo global depende de factores como la vía de inyección, la composición de las partículas y las comorbilidades del paciente.
Algunos posibles signos y síntomas de un efecto adverso incluyen dolor, debilidad, hinchazón, parálisis, fiebre, respiración dificultosa o rápida, vómitos, disminución del nivel de actividad, vocalización o pérdida del conocimiento. Si observa alguno de estos o cualquier otro signo preocupante en un animal al que se le haya administrado este producto, póngase en contacto con un veterinario lo antes posible.
La inyección de clorhidrato de dexmedetomidina de 0,5 mg/ml está indicada para su uso como sedante y analgésico en perros y gatos.
Los clientes que hayan recibido Dexased™ (Aspen) y DexMedVet™ (Cronus Pharma LLC) de los lotes (C24041AV1 y C24041AV2) que se están retirando del mercado deben dejar de usar los productos y consultar su carta de retirada para ver las instrucciones de devolución del producto. Cronus Pharma LLC está trabajando con sus socios distribuidores para garantizar que el producto no utilizado ya no esté en distribución ni entre los clientes. Estamos notificando directamente a nuestros distribuidores y clientes y estamos organizando la devolución del producto retirado del mercado.
En caso de que su animal sufra daños a causa de este producto, es importante que lo denuncie. Puede ayudar a detectar y resolver problemas y evitar que otras personas sufran daños, y permite una mejor vigilancia.
Fuente: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/cronus-pharma-llc-initiating-voluntary-recall-dexasedtm-aspen-and-dexmedvettm-cronus-pharma-llc
Comentarios
Comentario