Recall notice
Die Hydrochlorid-Injektion von Dexased™ und Dexmedvet™ wurde aufgrund von Partikeln zurückgerufen, USA
vor 9 Monaten •source fda.gov
United States
CRONUS PHARMA LLC führt im Namen von Cronus Pharma Specialties, Hyderabad, Indien, einen freiwilligen Rückruf durch, bei dem es sich um eine Charge handelt, die aus zwei verschiedenen Chargen besteht: Dexased™ (Aspen) und Dexmedvet™ (Cronus Pharma LLC). Beide Produkte enthalten Dexmedetomidin-Hydrochlorid-Injektion 0,5 mg/ml, ein verschreibungspflichtiges Produkt in den Vereinigten Staaten, das bei Hunden und Katzen als Beruhigungsmittel und Analgetikum zur Erleichterung klinischer Untersuchungen, klinischer Eingriffe, kleinerer chirurgischer Eingriffe und kleinerer zahnärztlicher Eingriffe eingesetzt wird. Dieses Produkt ist auch zur Anwendung als Präanästhetikum zur Vollnarkose bei Hunden und Katzen geeignet.Der Rückruf erfolgt als Vorsichtsmaßnahme, da in der Lösung sichtbare Partikel (beschrieben als kristallartige Partikel, weiße Schwebestoffe oder Niederschläge) beobachtet wurden.
Bei der Sichtkontrolle der Kontrollproben der folgenden Chargen wurden kristallartige Partikel/schwimmendes weißes Stoff/Niederschlag beobachtet:
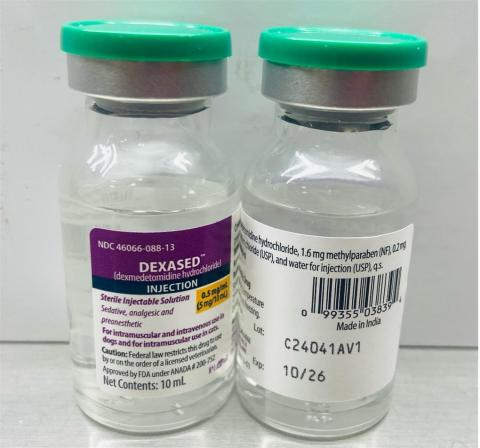
- Dexased™: Dexmedetomidin-Hydrochlorid-Injektion 0,5 mg/ml (Aspen), NDC-Nr.: 46066-088-13, Chargennummer: C24041AV1, Mfg. Datum: Nov. 2024, Exp. Datum: Oktober 2026.
- Vertriebstermine: Dezember 2024 bis 04. April 2025
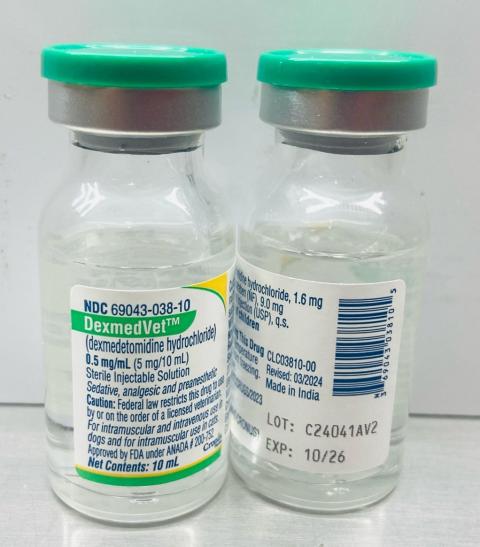
- DexMedVet™: Dexmedetomidin-Hydrochlorid-Injektion 0,5 mg/ml (Cronus Pharma LLC), NDC-Nr.: 69043-038-10, Chargennummer: C24041AV2, Mfg. Datum: Nov. 2024, Exp. Datum: Oktober 2026.
- Vertriebstermine: März 2025 bis 04. April 2025
Die Chargennummer (LOT) und das Verfallsdatum (EXP) befinden sich unten rechts auf dem Flaschenetikett.
Die Verabreichung eines injizierbaren Produkts, das Partikel enthält, kann zu schwerwiegenden Nebenwirkungen führen. Zu den möglichen Komplikationen gehören Entzündungen, Granulom, Fibrose und Verstopfung von Blutgefäßen in Herz, Lunge oder Gehirn, die zu Schlaganfällen oder lebensbedrohlichen Blutgerinnselerkrankungen bis hin zum Tod führen können. Das Gesamtrisiko hängt von Faktoren wie dem Injektionsweg, der Zusammensetzung der Partikel und den Begleiterkrankungen des Patienten ab.
Zu den möglichen Anzeichen und Symptomen einer Nebenwirkung gehören Schmerzen, Schwäche, Schwellung, Lähmung, Fieber, schweres oder schnelles Atmen, Erbrechen, vermindertes Aktivitätsniveau, Lautbildung oder Verlust des Bewusstseins. Wenn Sie eines dieser oder andere besorgniserregende Anzeichen bei einem Tier beobachten, dem dieses Tierarzneimittel verabreicht wurde, wenden Sie sich bitte so schnell wie möglich an einen Tierarzt.
Dexmedetomidin-Hydrochlorid-Injektion 0,5 mg/ml ist zur Anwendung als Beruhigungsmittel und Analgetikum bei Hunden und Katzen angezeigt.
Kunden, die Dexased™ (Aspen) und DexMedVet™ (Cronus Pharma LLC) aus den zurückgerufenen Chargen (C24041AV1 und C24041AV2) erhalten haben, sollten die Produkte nicht mehr verwenden und die Anweisungen zur Produktrückgabe in Ihrem Rückrufschreiben nachlesen. Cronus Pharma LLC arbeitet mit seinen Vertriebspartnern zusammen, um sicherzustellen, dass unbenutzte Produkte nicht mehr im Vertrieb oder bei Kunden sind. Wir benachrichtigen unsere Vertriebspartner und Kunden direkt und veranlassen die Rücksendung des zurückgerufenen Produkts.
Falls Ihr Tier durch dieses Produkt geschädigt wird, ist es wichtig, dies zu melden. Es kann helfen, Probleme zu erkennen und zu lösen und zu verhindern, dass andere verletzt werden, und es ermöglicht eine bessere Überwachung.
Quelle: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/cronus-pharma-llc-initiating-voluntary-recall-dexasedtm-aspen-and-dexmedvettm-cronus-pharma-llc
Bemerkungen
Kommentar