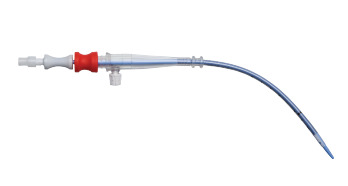
Recall notice
Se retira del mercado una cánula arterial debido al riesgo de exposición a cables, United States
hace 5 meses •source fda.gov
United States
Edwards Lifesciences ha emitido un retiro del mercado de modelos específicos de su cánula arterial debido al riesgo de exposición a los cables. Los productos afectados se distribuyeron en todo el país de los Estados Unidos y, si se usan, pueden presentar graves riesgos para la salud. La FDA ha emitido un retiro del mercado de más alto nivel para este dispositivo, en el que advierte que su uso podría provocar lesiones importantes o poner en peligro la vida.MOTIVO DE LA RETIRADA:
Edwards Lifesciences ha descubierto que, en algunos casos, un segmento de alambre de 3 mm a 4 mm de la bobina de refuerzo cerca de la punta de ciertas cánulas de perfusión arterial OptiSite puede quedar expuesto y desprenderse del cuerpo principal de la cánula. Debido a que ciertos modelos de cánulas arteriales femorales utilizan los mismos materiales y construcción, esos modelos también se incluyen en el retiro del mercado como medida de precaución.
El uso de un dispositivo con un cable expuesto puede presentar graves riesgos para el paciente, como una lesión tisular importante, una punción arterial que podría provocar hemorragias, un flujo sanguíneo insuficiente y daños en los glóbulos rojos (hemólisis).
PRODUCTOS AFECTADOS:
1) PRODUCTO: Cánula de perfusión arterial OptiSite
- Número de modelo: OPTI16
- ID DE USUARIO: 00690103180558
2) PRODUCTO: Cánula de perfusión arterial OptiSite
- Número de modelo: OPTI18
- ID DE USUARIO: 00690103180565
3) PRODUCTO: Cánula arterial femoral periférica
- Número de modelo: FEMII016A
- ID DE USUARIO: 00690103031232
4) PRODUCTO: Cánula arterial femoral periférica
- Número de modelo: FEMII016AS
- ID DE USUARIO: 00690103168341
5) PRODUCTO: Cánula arterial femoral periférica
- Número de modelo: FEMII018A
- ID DE USUARIO: 00690103031256
6) PRODUCTO: Cánula arterial femoral periférica
- Número de modelo: FEMII018AS
- IDENTIFICADOR DE USUARIO: 00690103168358
El problema se descubrió cuando se encontraron secciones de alambre expuestas en la punta de la cánula. El retiro, clasificado como Clase I por la FDA, se inició el 16 de mayo de 2025.
Si usted o un ser querido sufren daños o presentan algún síntoma, es importante informarlo. La notificación puede ayudar a detectar y resolver los brotes de manera temprana y evitar que otras personas sufran daños, y permite una mejor vigilancia. Si los síntomas persisten, busca atención médica.
Fuente: www.fda.gov/medical-devices/medical-device-recalls/arterial-cannula-recall-edwards-lifesciences-removes-arterial-cannula-due-risk-wire-exposure
Comentarios
Comentario