Recall notice
تم سحب القنية الشريانية بسبب خطر التعرض للأسلاك, United States
منذ 5 أشهر •source fda.gov
United States
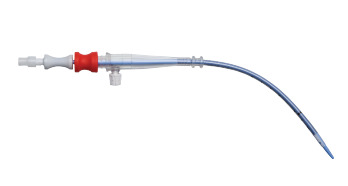
أصدرت Edwards Lifesciences استدعاءً لنماذج محددة من قنية الشرايين بسبب خطر التعرض للأسلاك. تم توزيع المنتجات المتأثرة على الصعيد الوطني في الولايات المتحدة وقد تشكل مخاطر صحية خطيرة إذا تم استخدامها. أصدرت إدارة الغذاء والدواء الأمريكية (FDA) استرجاعًا على أعلى مستوى لهذا الجهاز، محذرة من أن استخدامه قد يؤدي إلى إصابة كبيرة أو قد يكون مهددًا للحياة.سبب الاستدعاء:
اكتشفت شركة Edwards Lifesciences، في بعض الحالات، أن مقطعًا من السلك يتراوح من 3 مم إلى 4 مم من ملف التعزيز بالقرب من طرف بعض قنيات التروية الشريانية OptiSite قد ينكشف وينفصل عن الجسم الرئيسي للقنية. نظرًا لأن بعض نماذج قنية الشرايين الفخذية تستخدم نفس المواد والبناء، يتم أيضًا تضمين هذه النماذج في الاستدعاء كإجراء احترازي.
قد يؤدي استخدام جهاز بسلك مكشوف إلى مخاطر خطيرة على المريض، بما في ذلك إصابة الأنسجة الكبيرة، وثقب الشرايين الذي قد يؤدي إلى النزيف، وعدم كفاية تدفق الدم، وتلف خلايا الدم الحمراء (انحلال الدم).
المنتجات المتأثرة:
1) المنتج: قنية التروية الشريانية OptiSite
- رقم الموديل: OPTI16
- رقم التعريف: 00690103180558
2) المنتج: قنية التروية الشريانية OptiSite
- رقم الموديل: OPTI18
- رقم التعريف: 00690103180565
3) المنتج: قنية الشرايين الفخذية الطرفية
- رقم الموديل: FEMII016A
- معرف الصوت: 00690103031232
4) المنتج: قنية الشرايين الفخذية الطرفية
- رقم الموديل: FEMII016AS
- رقم التعريف: 00690103168341
5) المنتج: قنية الشرايين الفخذية الطرفية
- رقم الموديل: FEMII018A
- معرف الصوت: 00690103031256
6) المنتج: قنية الشرايين الفخذية الطرفية
- رقم الموديل: FEMII018AS
- رقم التعريف: 00690103168358
تم اكتشاف المشكلة عندما تم العثور على أجزاء من الأسلاك مكشوفة عند طرف الكانيولا. بدأ الاستدعاء، المصنف على أنه من الدرجة الأولى من قبل إدارة الغذاء والدواء الأمريكية، في 16 مايو 2025.
إذا تعرضت أنت أو أحد أفراد أسرتك للأذى أو واجهت أي أعراض، فمن المهم الإبلاغ عن ذلك. يمكن أن يساعد الإبلاغ في اكتشاف حالات تفشي المرض وحلها مبكرًا ومنع الآخرين من التعرض للأذى، وتمكين المراقبة بشكل أفضل. إذا استمرت الأعراض، فاطلب الرعاية الطبية.
المصدر: www.fda.gov/medical-devices/medical-device-recalls/arterial-cannula-recall-edwards-lifesciences-removes-arterial-cannula-due-risk-wire-exposure
تعليقات
تعليق