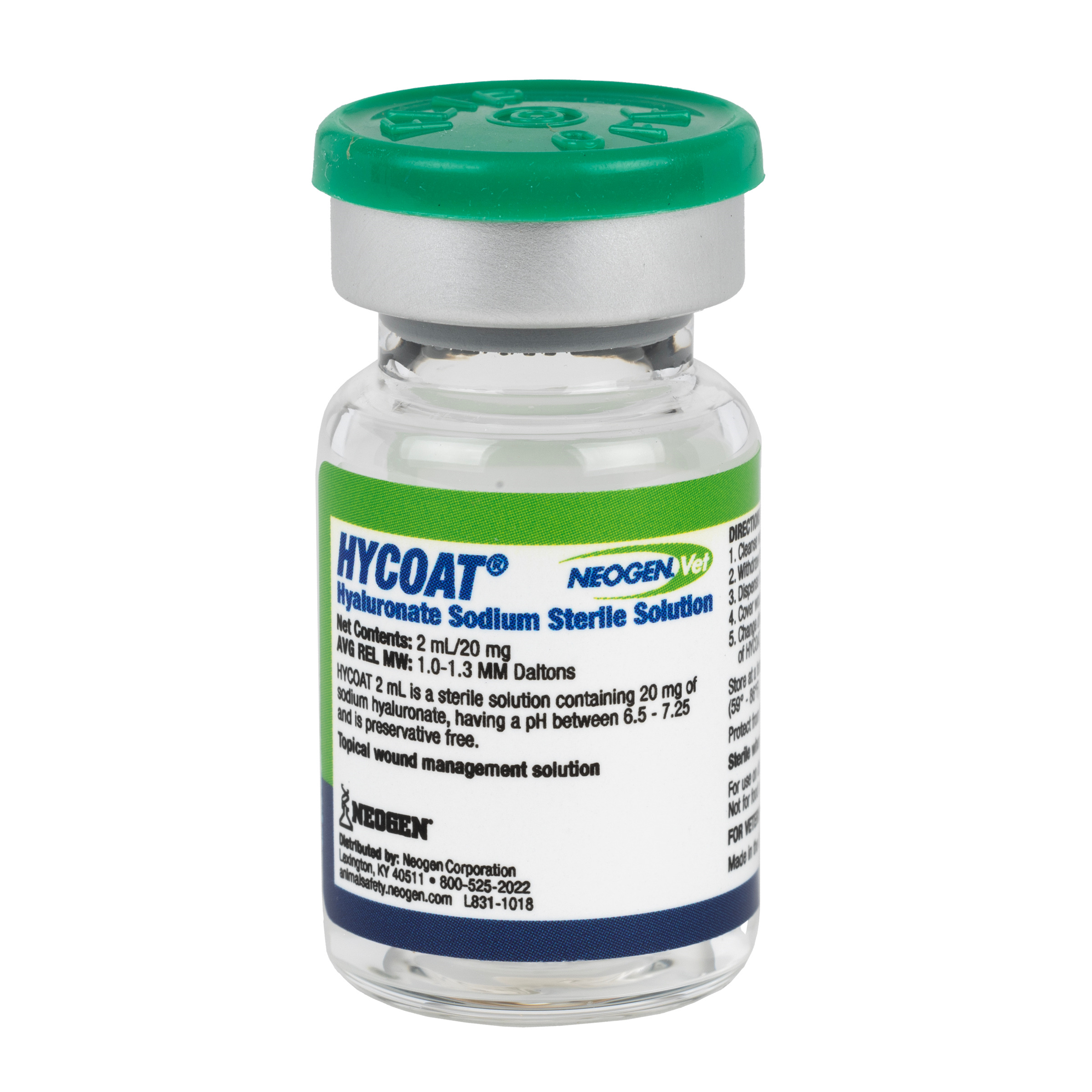
Recall notice
Neogen Vet HYCOAT® Solução Estéril de Hialuronato de Sódio recolhida devido a Contaminação Microbiana, USA
há 3 semanas •source fda.gov
United States
A Neogen Corporation (NASDAQ: NEOG) está retirando voluntariamente todos os lotes dentro do prazo de validade da Solução Estéril de Hialuronato de Sódio Neogen®Vet HYCOAT®, para uso em cães, gatos e cavalos, ao nível veterinário. A Neogen distribui este produto, que é fabricado por um fornecedor terceirizado. A Neogen recebeu vários relatórios de eventos adversos em cavalos após injeções intra-articulares deste produto, o que é inconsistente com seu uso rotulado e pretendido. A Solução Estéril de Hialuronato de Sódio Neogen®Vet HYCOAT® foi distribuída nacionalmente para distribuidores de saúde animal e veterinários.Enquanto a investigação da empresa sobre esta questão está em andamento, por excesso de cautela, os frascos do produto de 2mL/20mg também estão sendo retirados.
Declaração de Risco: Este produto é rotulado como uma solução estéril, mas devido à contaminação microbiana de certos lotes, os lotes retirados não devem mais ser considerados estéreis. Frascos que contêm um contaminante microbiano potencialmente resultam em infecção no animal. O risco é particularmente agudo quando usado como injeção intra-articular (o que é inconsistente com seu uso rotulado e pretendido). Há também um risco se usado de acordo com o rótulo como sistema de gerenciamento tópico de feridas em feridas cirúrgicas, queimaduras, úlceras e procedimentos de autoenxerto. Até o momento, a Neogen não recebeu relatórios de eventos adversos quando usado de maneira consistente com o uso rotulado.
O produto é destinado para uso como sistema de gerenciamento tópico de feridas e é embalado em frascos de 2mL/20 mg (Código UPC 726087089386) e 10mL/50mg (Código UPC 726087089393).
Os lotes do produto em questão dentro do prazo de validade incluem os seguintes:
Números de lote de 2 mL/20 mg: 0236735, 0236736, 0336746, 0336747, 0536760, 0536761, 0636768, 0636769, 0836792, 0836785, 0836788, 0836789, 0936794, 0936795, 1036801, 1036802, 1036803, 1036804, 1136807, 1136808, 0246837, 0246838, 4L001B, 4L002
Números de lote de 10 mL/50 mg: 0136731, 0736777, 0346843, 5A001
Esta retirada foi iniciada devido à contaminação microbiana em certos lotes de frascos do produto de 10 mL/50 mg.
Comentários
Comentário