Recall notice
Prazosin-Hydrochlorid, Kapseln zurückgerufen aufgrund von CGMP-Abweichungen, United States
vor 5 Monaten •source accessdata.fda.gov
United States
Teva Pharmaceuticals USA, Inc. hat einen freiwilligen Rückruf von Prazosin-Hydrochlorid-Kapseln aufgrund von CGMP-Abweichungen eingeleitet. Der Rückruf betrifft landesweit in den USA vertriebene Produkte aufgrund von Testergebnissen, die Verunreinigungsgrade über den akzeptablen Grenzwerten zeigen. Insgesamt sind 580.844 Flaschen betroffen.BETROFFENE PRODUKTE:
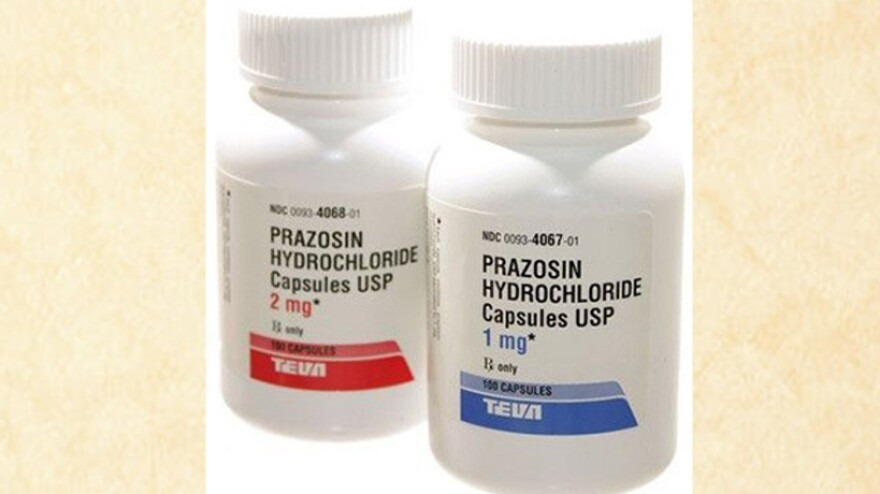
PRODUKT: Prazosin-Hydrochlorid-Kapseln, USP, 1 mg (nur auf Rezept)
- Größe: 100 Kapseln / 1000 Kapseln
- NDC: 0093-4067-01 / 0093-4067-10
- Charge: 3010544A, 3010545A
- Verfallsdatum: 10/2025
- Produktmenge: 181.659 Flaschen
- Vertrieben von TEVA Pharmaceuticals USA, Inc.
PRODUKT: Prazosin-Hydrochlorid-Kapseln, USP, 2 mg (nur auf Rezept)
- Größe: 100 Kapseln / 1000 Kapseln
- NDC: 0093-4068-01 / 0093-4068-10
- Charge: 3010398A, 3010399A, 3010400A, 3010401A, 3010353A, 3010439A, 3010388A, 3010526A, 3010527A, 3010591A, 3010343A, 3010352A, 3010468A, 3010469A, 3010461A
- Verfallsdatum: 10/2025 – 07/2026
- Produktmenge: 291.512 Flaschen
- Vertrieben von TEVA Pharmaceuticals USA, Inc.
PRODUKT: Prazosin-Hydrochlorid-Kapseln, USP, 5 mg (nur auf Rezept)
- Größe: 100 Kapseln / 250 Kapseln / 500 Kapseln
- NDC: 0093-4069-01 / 0093-4069-52 / 0093-4069-05
- Charge: 3010403A, 3010385A, 3010404A, 3010405A, 3010510A, 3010528A, 3010354A, 3010592A, 3010605A, 3010611A, 3010612A
- Verfallsdatum: 02/2026 – 03/2026
- Produktmenge: 107.673 Flaschen
- Vertrieben von TEVA Pharmaceuticals USA, Inc.
Grund für den Rückruf:
CGMP-Abweichungen - Testergebnisse für N-Nitroso-Prazosin-Verunreinigung C, die über dem akzeptablen Aufnahmegrenzwert des Carcinogenic Potency Categorization Approach (CPCA) für die oben genannten Chargen liegen.
Das Problem wurde durch Testergebnisse identifiziert, die N-Nitroso-Prazosin-Verunreinigung C-Werte über den Grenzwerten des Carcinogenic Potency Categorization Approach anzeigen. Der als Klasse II klassifizierte Rückruf wurde am 7. Oktober 2025 eingeleitet und am 24. Oktober 2025 klassifiziert.
Quelle: www.accessdata.fda.gov/scripts/ires/
23
Bemerkungen
Kommentar