Recall notice
Cloridrato de Prazosina, Cápsulas recolhidas devido a desvios de CGMP, United States
há 5 meses •source accessdata.fda.gov
United States
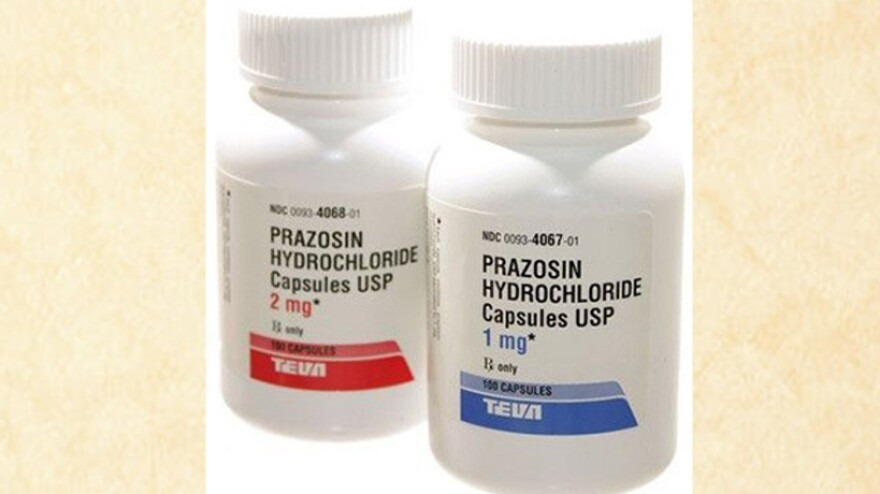
A Teva Pharmaceuticals USA, Inc. iniciou um recall voluntário de cápsulas de Cloridrato de Prazosina devido a desvios de CGMP. O recall afeta produtos distribuídos nacionalmente nos EUA devido a resultados de testes mostrando níveis de impurezas acima dos limites aceitáveis. Um total de 580.844 frascos são afetados.PRODUTOS AFETADOS:
PRODUTO: Cápsulas de Cloridrato de Prazosina, USP, 1 mg (Apenas com receita)
- Tamanho: 100 Cápsulas / 1000 Cápsulas
- NDC: 0093-4067-01 / 0093-4067-10
- Lote: 3010544A, 3010545A
- Data de Validade: 10/2025
- Quantidade do Produto: 181.659 frascos
- Distribuído pela TEVA Pharmaceuticals USA, Inc.
PRODUTO: Cápsulas de Cloridrato de Prazosina, USP, 2 mg (Apenas com receita)
- Tamanho: 100 Cápsulas / 1000 Cápsulas
- NDC: 0093-4068-01 / 0093-4068-10
- Lote: 3010398A, 3010399A, 3010400A, 3010401A, 3010353A, 3010439A, 3010388A, 3010526A, 3010527A, 3010591A, 3010343A, 3010352A, 3010468A, 3010469A, 3010461A
- Data de Validade: 10/2025 – 07/2026
- Quantidade do Produto: 291.512 frascos
- Distribuído pela TEVA Pharmaceuticals USA, Inc.
PRODUTO: Cápsulas de Cloridrato de Prazosina, USP, 5 mg (Apenas com receita)
- Tamanho: 100 Cápsulas / 250 Cápsulas / 500 Cápsulas
- NDC: 0093-4069-01 / 0093-4069-52 / 0093-4069-05
- Lote: 3010403A, 3010385A, 3010404A, 3010405A, 3010510A, 3010528A, 3010354A, 3010592A, 3010605A, 3010611A, 3010612A
- Data de Validade: 02/2026 – 03/2026
- Quantidade do Produto: 107.673 frascos
- Distribuído pela TEVA Pharmaceuticals USA, Inc.
Razão para o recall:
Desvios de CGMP - Resultados de testes para impureza C de N-nitroso Prazosina que estão acima do limite de ingestão aceitável da Abordagem de Categorização de Potência Carcinogênica (CPCA) para os lotes especificados acima.
O problema foi identificado através de resultados de testes indicando níveis de impureza C de N-nitroso Prazosina acima dos limites da Abordagem de Categorização de Potência Carcinogênica. O recall, classificado como Classe II, foi iniciado em 7 de outubro de 2025 e classificado em 24 de outubro de 2025.
Fonte: www.accessdata.fda.gov/scripts/ires/
23
Comentários
Comentário