Recall notice
AVKARE Augentropfen wegen Sterilitätsproblemen zurückgerufen, United States
vor 9 Monaten •source avkare.com
United States
BRS Analytical Service, LLC. hat einen freiwilligen Rückruf verschiedener ophthalmologischer Produkte eingeleitet, da bei einem FDA-Audit Herstellungsabweichungen festgestellt wurden. Das potenzielle Gesundheitsrisiko für Benutzer ist derzeit nicht bekannt, aber die Abweichungen können zu Produkten von inakzeptabler Qualität führen. Der Rückruf wurde eingeleitet, nachdem die FDA bei einem Audit Herstellungsabweichungen festgestellt hatte. Das potenzielle Risiko für Patienten durch die Anwendung dieser Produkte kann nicht ausgeschlossen werden. Der Rückruf wird mit Wissen der US-amerikanischen Food and Drug Administration durchgeführt. Die Produkte wurden zwischen dem 26. Mai 2023 und dem 21. April 2025 national versendet. Dies hat sich nur auf Einzelhandelsebene geändert.BETROFFENE PRODUKTE
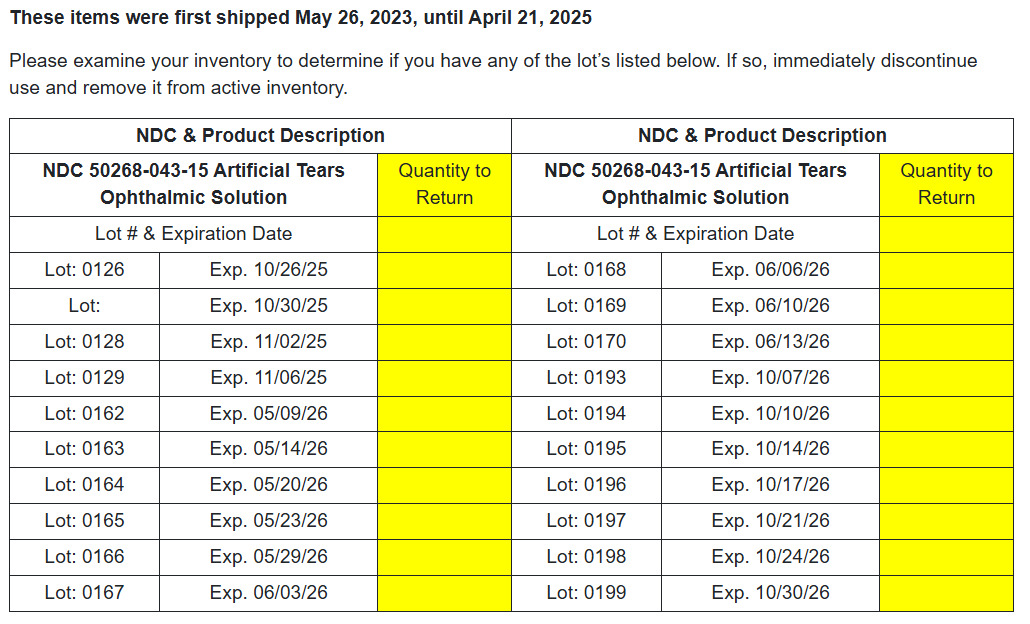
NDC# 50268-043-15 Augenlösung für künstliche Tränen
NDC# 50268-066-15 Carboxymethylcellulose-Natrium-Augengel 1%
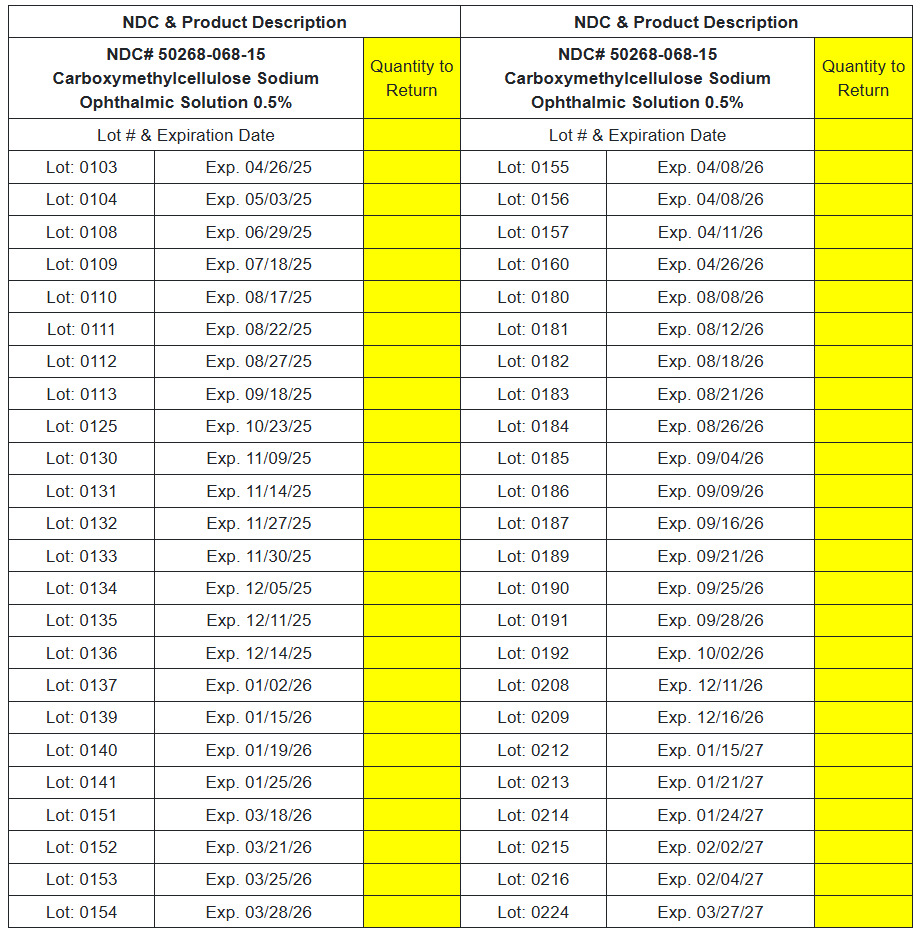
NDC# 50268-068-15 Carboxymethylcellulose-Natrium-Augenlösung
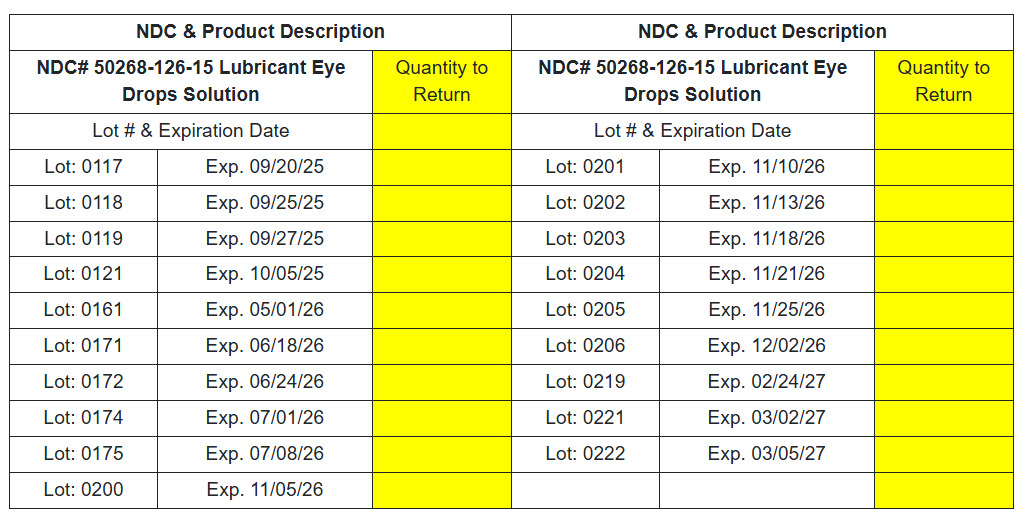
NDC# 50268-126-15 Gleitmittellösung für Augentropfen
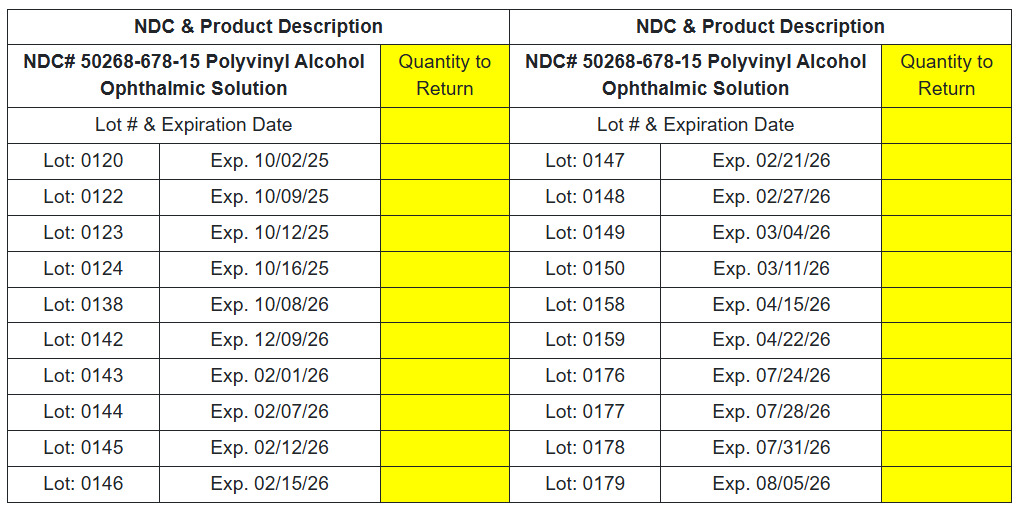
NDC# 50268-678-15 Augenlösung aus Polyvinylalkohol
Sie können die betroffenen Produktdetails unter dem folgenden Link überprüfen.
Verbrauchern wird empfohlen, das Produkt nicht zu verwenden und es an den Ort zurückzugeben, an dem sie es gekauft haben.
Wenn Sie oder eine geliebte Person verletzt sind oder Symptome haben, ist es wichtig, dies zu melden. Die Berichterstattung kann dazu beitragen, Ausbrüche frühzeitig zu erkennen und zu beheben und zu verhindern, dass andere geschädigt werden, und ermöglicht eine bessere Überwachung. Wenn die Symptome anhalten, suchen Sie einen Arzt auf.
Quelle: www.avkare.com/recall
22
Bemerkungen
Kommentar