Recall notice
Rappel de gouttes ophtalmiques AVKARE en raison de problèmes de stérilité, United States
il y a 9 mois •source avkare.com
United States
BRS Analytical Service, LLC. a lancé un rappel volontaire de divers produits ophtalmiques en raison d'écarts de fabrication identifiés lors d'un audit de la FDA. Le danger potentiel pour la santé des utilisateurs est actuellement inconnu, mais les écarts peuvent conduire à des produits d'une qualité inacceptable. Le rappel a été lancé après que la FDA a identifié des écarts de fabrication lors d'un audit. Le risque potentiel pour les patients lié à l'utilisation de ces produits ne peut être exclu. Le rappel est effectué avec la connaissance de la Food and Drug Administration des États-Unis. Les produits ont été expédiés à l'échelle nationale entre le 26 mai 2023 et le 21 avril 2025. Cela n'a été modifié qu'au niveau de la vente au détail.PRODUITS CONCERNÉS
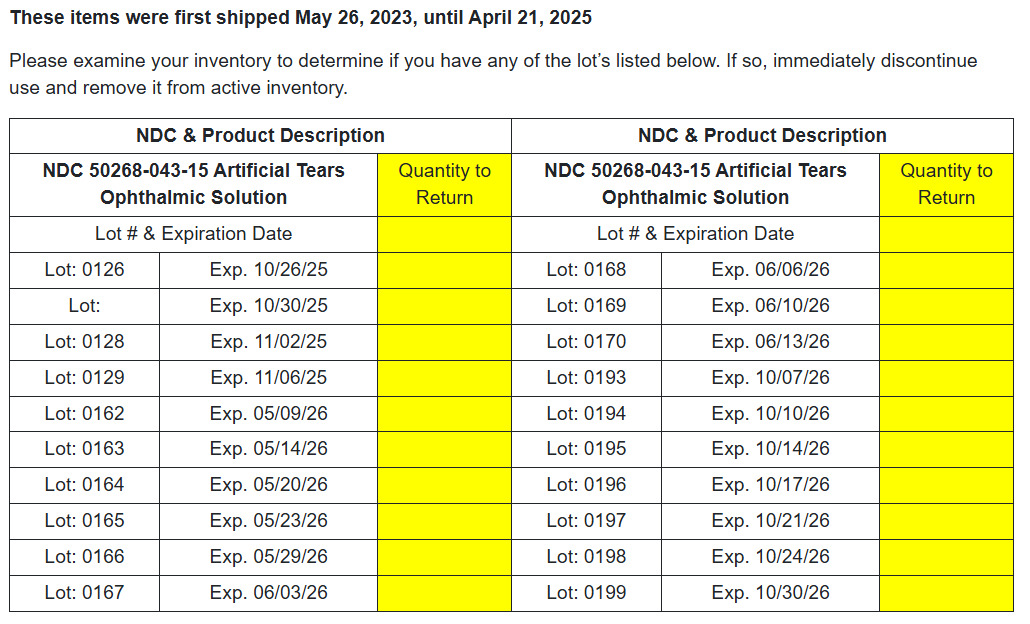
Solution ophtalmique pour larmes artificielles NDC# 50268-043-15
NDC# 50268-066-15 Gel ophtalmique à base de carboxyméthylcellulose sodique à 1 %
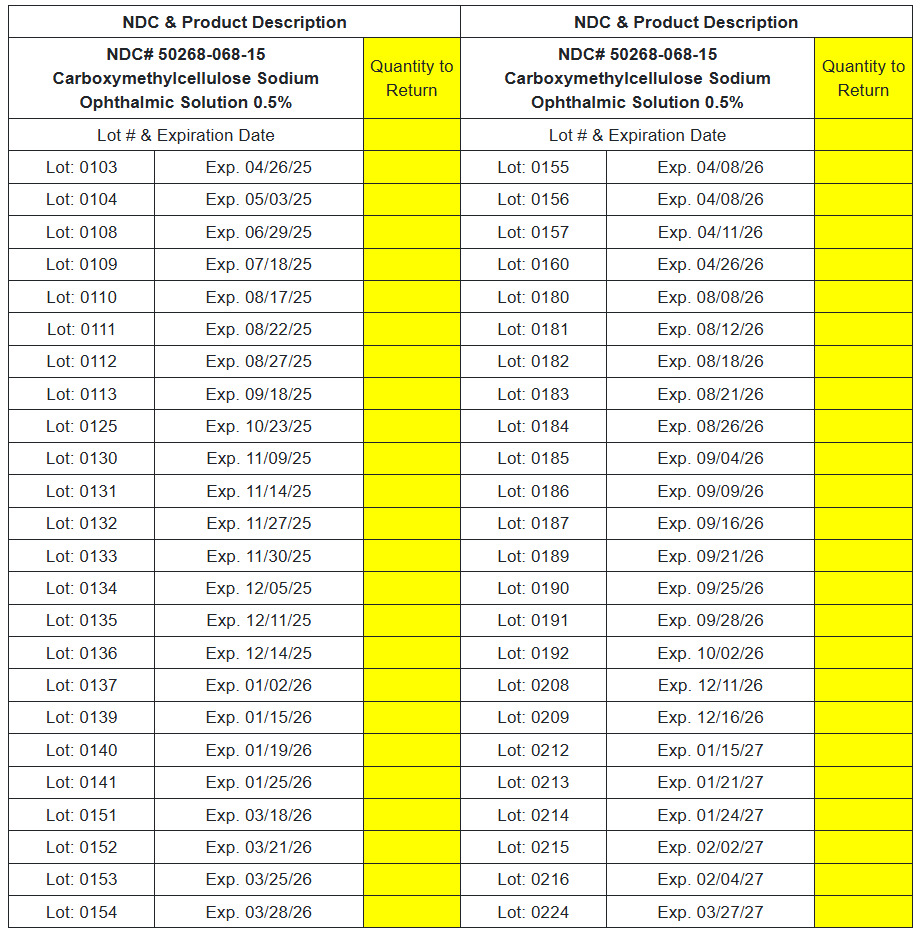
NDC# 50268-068-15 Solution ophtalmique de carboxyméthylcellulose sodique
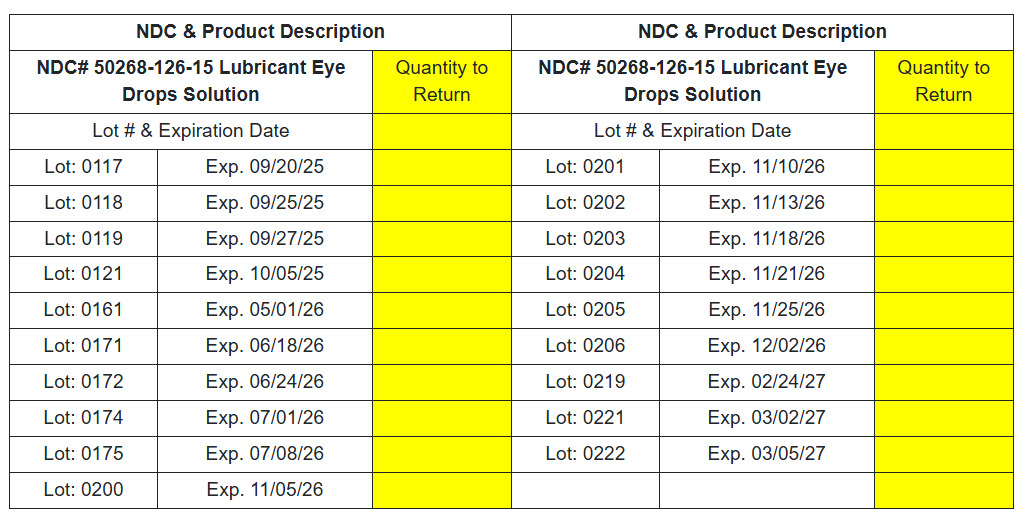
Solution de gouttes oculaires lubrifiantes NDC# 50268-126-15
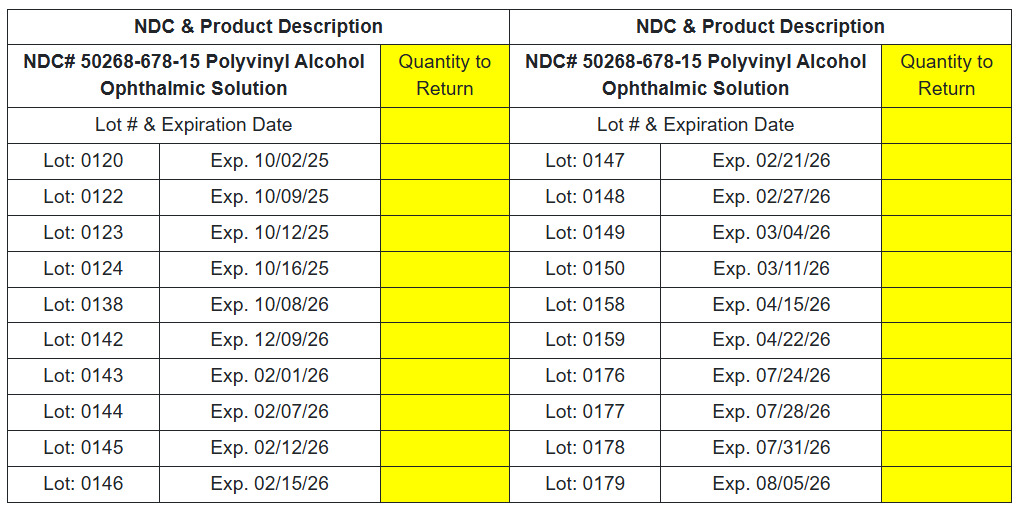
Solution ophtalmique d'alcool polyvinylique NDC# 50268-678-15
Vous pouvez consulter les détails du produit concerné en cliquant sur le lien ci-dessous.
Il est conseillé aux consommateurs de ne pas utiliser le produit et de le retourner à l'endroit où ils l'ont acheté.
Si vous ou un proche êtes blessé ou si vous présentez des symptômes, il est important de le signaler. Le signalement peut aider à détecter et à résoudre les épidémies à un stade précoce et à empêcher que d'autres personnes ne soient blessées, et permet une meilleure surveillance. Si les symptômes persistent, consultez un médecin.
Une source : www.avkare.com/recall
22
Commentaires
Commentaire