Recall notice
Riomet ER - retirado debido a impureza NDMA, USA
hace 5 años •source fda.gov
United States
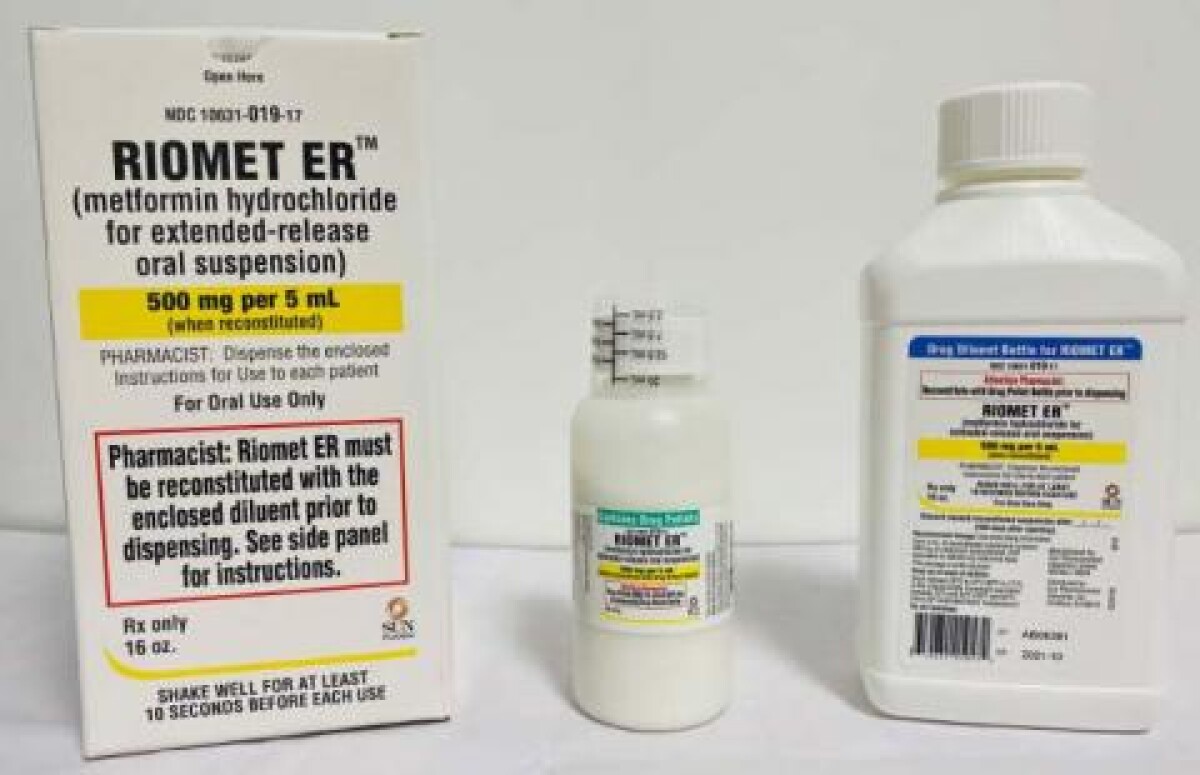
Nombre empresa: Sun Pharmaceutical IndustriesNombre de la marca: Riomet ER
Producto retirado: Hidrocloruro de metformina para suspensión oral de liberación prolongada
Razón de la retirada: Debido a la detección de impurezas de N-Nitrosodimetilamina (NDMA)
Fecha de retirada de la FDA: 23 de septiembre de 2020
Recordemos detalles: Sun Pharmaceutical Industries, Inc. (SUN PHARMA), una filial de propiedad total de Sun Pharmaceutical Industries Ltd. está recordando voluntariamente un lote de RIOMET ER™ (clorhidrato de metformina para suspensión oral de liberación prolongada), 500 mg por 5 mL al nivel del consumidor. La razón de la retirada se debe al nivel de N-Nitrosodimetilamina (NDMA), que se ha encontrado que está por encima del límite permitido de ingesta diaria aceptable (IDA) establecido por la Administración de Alimentos y Medicamentos de los Estados Unidos. El NDMA se clasifica como un posible carcinógeno humano (una sustancia que podría causar cáncer) según los resultados de las pruebas de laboratorio.
NDMA es un contaminante ambiental conocido que se encuentra en el agua y los alimentos, incluyendo carnes, productos lácteos y verduras. Hasta la fecha, SUN PHARMA no ha recibido ningún reporte de eventos adversos relacionados con este retiro. RIOMET ER™ (clorhidrato de metformina para suspensión oral de liberación prolongada) es un medicamento oral recetado indicado como complemento a la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2. RIOMET ER™, una vez reconstituido, se envasa en una botella redonda de 473 mL. Cada caja contiene una botella de pellets de drogas, una botella de diluyente y una taza dosificadora. El RIOMET ER™ afectado es el siguiente lote:
- RIOMET ER™ (clorhidrato de metformina para suspensión oral de liberación prolongada) 500 mg por 5 mL. Lote # AB06381. NDC #10631 -019-17. Fecha de caducidad: 10/2021. Número de unidades: 747 cajas.
El producto puede identificarse mediante las botellas o envases etiquetados como RIOMET ER™ (clorhidrato de metformina para suspensión oral de liberación prolongada), que contienen el número de lote específico y la fecha de caducidad mencionados anteriormente o en el etiquetado siguiente. El producto se distribuyó en todo el país a los clientes mayoristas.
SUN PHARMA está notificando a sus distribuidores y clientes a través de su coordinador de retirada de terceros (Inmar Inc.), a través del envío estándar de FedEx durante la noche y organizará la devolución de todos los productos retirados.
Los distribuidores y minoristas que tengan RIOMET ER™ (clorhidrato de metformina para suspensión oral de liberación prolongada), que se está retirando, deben dejar de distribuir y devolverlo al lugar de compra o según se indica en la notificación de retirada.
Se aconseja a los pacientes que toman RIOMET ER™ (clorhidrato de metformina para suspensión oral de liberación prolongada), 500 mg por 5 mL que continúen tomando su medicamento y que se pongan en contacto con su farmacéutico, médico o médico para obtener asesoramiento sobre un tratamiento alternativo. Según la Administración de Alimentos y Medicamentos de los Estados Unidos, podría ser peligroso para los pacientes con esta grave afección dejar de tomar su metformina sin hablar primero con sus profesionales de la salud. Por favor, visite el sitio web de la agencia para obtener más información en www.fda.gov/drugs/drug-safety-andavailability/fda-updates-and-press-announcements-ndma-metformin.
Los consumidores con preguntas relacionadas con este retiro pueden ponerse en contacto con SUN PHARMA llamando al 1-800-818-4555 de lunes a viernes de 8:00am a 5:00pm EST o enviando un correo electrónico a drug.safetyUSA@sunpharma.com. Los consumidores deben ponerse en contacto con su médico o proveedor de atención médica si han experimentado algún problema que pueda estar relacionado con la toma o el uso de este medicamento.
Consulta todos los detalles de la retirada en www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/sun-pharmaceutical-industries-inc-issues-voluntary-nationwide-recall-riomet-ertm-metformin
Fuente: FDA
312
Comentarios
Comentario