Recall notice
Rappel de Riomet en raison de l'impureté de la NDMA, USA
il y a 5 ans •source fda.gov
United States
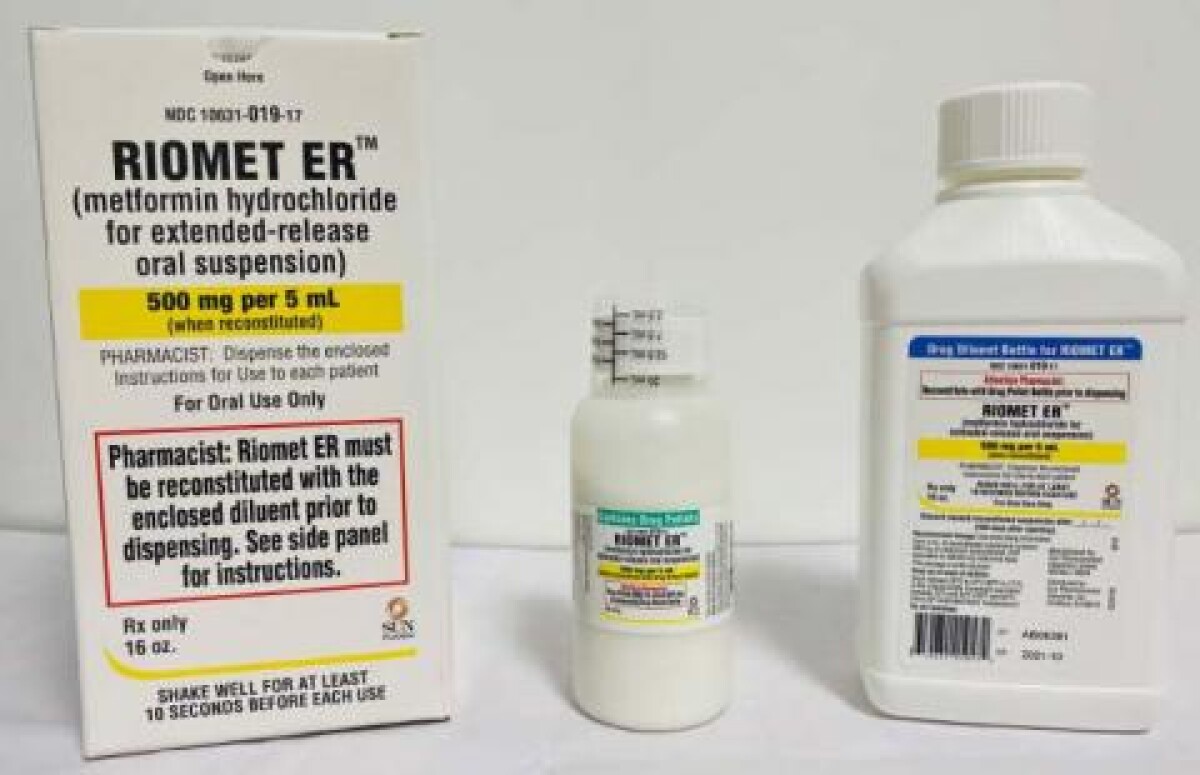
Nom d'entreprise : Sun Pharmaceutical IndustriesMarque : Riomet ER
Produit rappelé : chlorhydrate de metformine pour suspension buccale à libération prolongée
Raison du rappel : En raison de la détection d'impuretés de N-nitrosodiméthylamine (NDMA)
Date de rappel de la FDA : 23 septembre 2020
Détails du rappel : Sun Pharmaceutical Industries, Inc. (SUN PHARMA), une filiale en propriété exclusive de Sun Pharmaceutical Industries Ltd., retire volontairement un lot de RIOMET ER™ (chlorhydrate de metformine pour suspension orale à libération prolongée), 500 mg par 5 mL au niveau du consommateur. La raison du rappel est attribuable à la concentration de N-nitrosodiméthylamine (NDMA), qui s'est avérée supérieure à la limite d'apport journalier admissible (DJA) établie par la Food and Drug Administration des États-Unis. La NDMA est classée comme cancérogène probable pour l'homme (une substance qui pourrait causer le cancer) d'après les résultats des tests de laboratoire.
La NDMA est un contaminant environnemental connu qui se trouve dans l'eau et les aliments, y compris les viandes, les produits laitiers et les légumes. À ce jour, SUN PHARMA n'a reçu aucun rapport d'effets indésirables liés à ce rappel. RIOMET ER™ (chlorhydrate de metformine pour suspension orale à libération prolongée) est un médicament oral sur ordonnance indiqué comme complément à l'alimentation et à l'exercice pour améliorer le contrôle glycémique chez les adultes et les enfants de 10 ans et plus atteints de diabète sucré de type 2. RIOMET ER™, une fois reconstitué, est emballé dans un flacon rond de 473 ml (16 oz). Chaque boîte contient une bouteille de pastilles de drogue, une bouteille de diluant et une tasse doseuse. Le RIOMET ER™ touché est le lot suivant :
- RIOMET ER™ (chlorhydrate de metformine pour suspension buvable à libération prolongée) 500 mg par 5 mL. Lot # AB06381. NDC #10631 -019-17. Date d'expiration : 10/2021. Nombre d'unités : 747 cartons.
Le produit peut être identifié par les bouteilles ou les boîtes étiquetées comme RIOMET ER™ (chlorhydrate de metformine pour suspension buvable à libération prolongée), contenant le numéro de lot et la date de péremption mentionnés ci-dessus ou sur l'étiquette ci-dessous. Le produit a été distribué à l'échelle nationale aux clients de gros.
SUN PHARMA avise ses distributeurs et ses clients par l'intermédiaire de son coordonnateur des rappels tiers (Inmar Inc.), par le biais de l'expédition standard de FedEx pendant la nuit et prendra des dispositions pour le retour de tous les produits rappelés.
Les distributeurs et les détaillants qui ont RIOMET ER™ (chlorhydrate de metformine pour suspension buvable à libération prolongée), qui fait l'objet d'un rappel, doivent cesser de distribuer et le retourner au lieu d'achat ou comme indiqué dans l'avis de rappel.
Il est conseillé aux patients prenant RIOMET ER™ (chlorhydrate de metformine pour suspension buvable à libération prolongée), 500 mg par 5 mL de continuer à prendre leur médicament et de communiquer avec leur pharmacien, leur médecin ou leur professionnel de la santé pour obtenir des conseils concernant un autre traitement. Selon la Food & Drug Administration des États-Unis, il pourrait être dangereux pour les patients atteints de cette affection grave d'arrêter de prendre leur metformine sans d'abord parler à leurs professionnels de la santé. Veuillez consulter le site Web de l'agence pour obtenir de plus amples renseignements à l'adresse www.fda.gov/drugs/drug-safety-andavailability/fda-updates-and-press-announcements-ndma-metformin.
Les consommateurs qui ont des questions au sujet de ce rappel peuvent communiquer avec SUN PHARMA en composant le 1-800-818-4555 du lundi au vendredi entre 8 h et 17 h HNE ou en envoyant un courriel à drug.safetyUSA@sunpharma.com. Les consommateurs doivent communiquer avec leur médecin ou leur fournisseur de soins de santé s'ils ont éprouvé des problèmes pouvant être liés à la prise ou à l'utilisation de ce médicament.
Consultez les détails complets du rappel sur www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/sun-pharmaceutical-industries-inc-issues-voluntary-nationwide-recall-riomet-ertm-metformin
Source : FDA
312
Commentaires
Commentaire