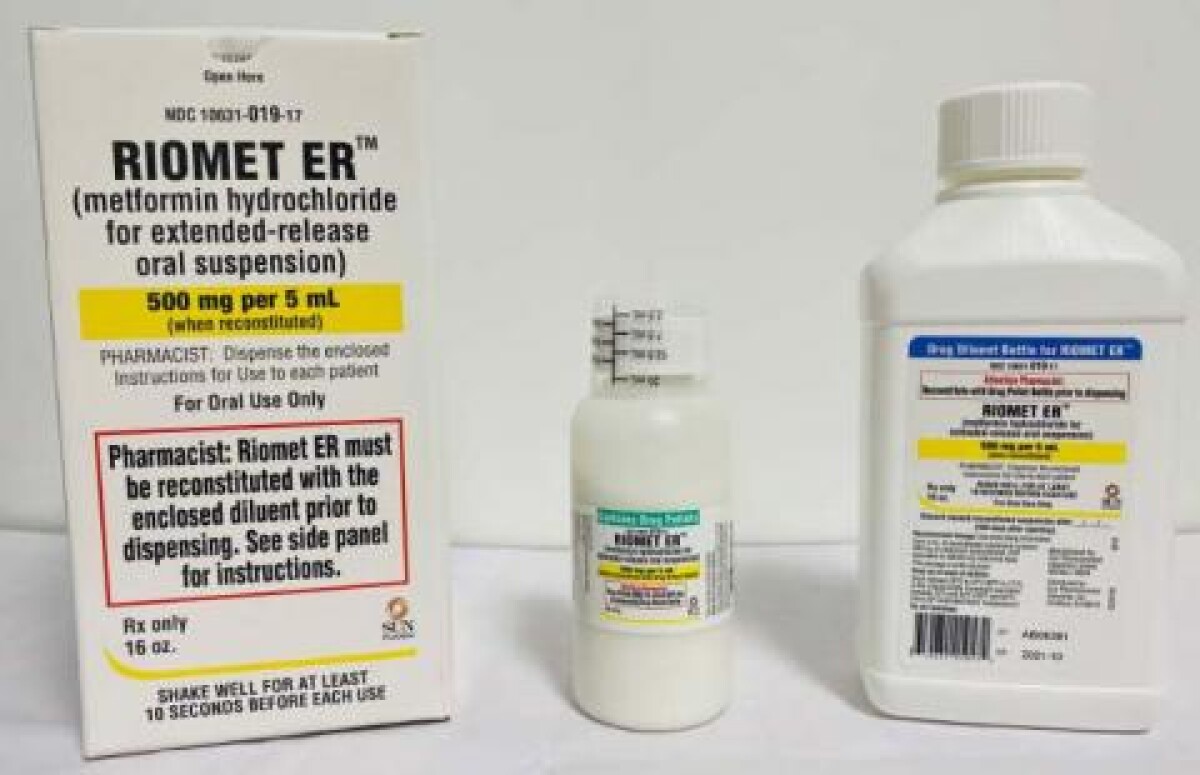
Recall notice
里奥梅特 ER-由于 NDMA 杂质而召回, USA
5年前 •source fda.gov
United States
该产品在全国范围内销售给批发客户。SUN PHARMA 通过其第三方召回协调员(Inmar Inc.)通过 FedEx 标准隔夜运输通知其分销商和客户,并将安排退回所有召回产品。
拥有 RIOMET ER™(用于延长释放口服悬浮液的盐酸二甲双胍)的经销商和零售商应停止分销并将其退回购买地点或按召回通知中的指示进行。
建议服用 RIOMET ER™(盐酸二甲双胍延期释放口服悬浮液),每 5 毫升 500 毫克的患者继续服用药物,并联系药剂师、医生或医疗提供者,以获取有关替代治疗的建议。据美国食品药品管理局称,如果患有这种严重疾病的患者不首先与医疗保健专业人员交谈,就停止服用二甲双胍可能是危险的。有关更多信息,请访问该机构的网站:www.fda.gov/drugs/drug-safety-andavailability/fda-updates-and-press-announcements-ndma-metformin。
如果消费者对此次召回有任何疑问,可在美国东部时间周一至周五上午 8:00 至下午 5:00 之间致电 1-800-818-4555,或发送电子邮件至 drug.safetyUSA@sunpharma.com。消费者如遇到任何可能与服用或使用该药物产品有关的问题,应与其医生或医疗保健提供者联系。
查看 www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/sun-pharmaceutical-industries-inc-issues-voluntary-nationwide-recall-riomet-ertm-metformin 上的完整召回详细信息
资料来源:林业发展局
312
评论
评论