Recall notice
Riomet ER - recordado devido a devido a impureza NDMA, USA
há 5 anos •source fda.gov
United States
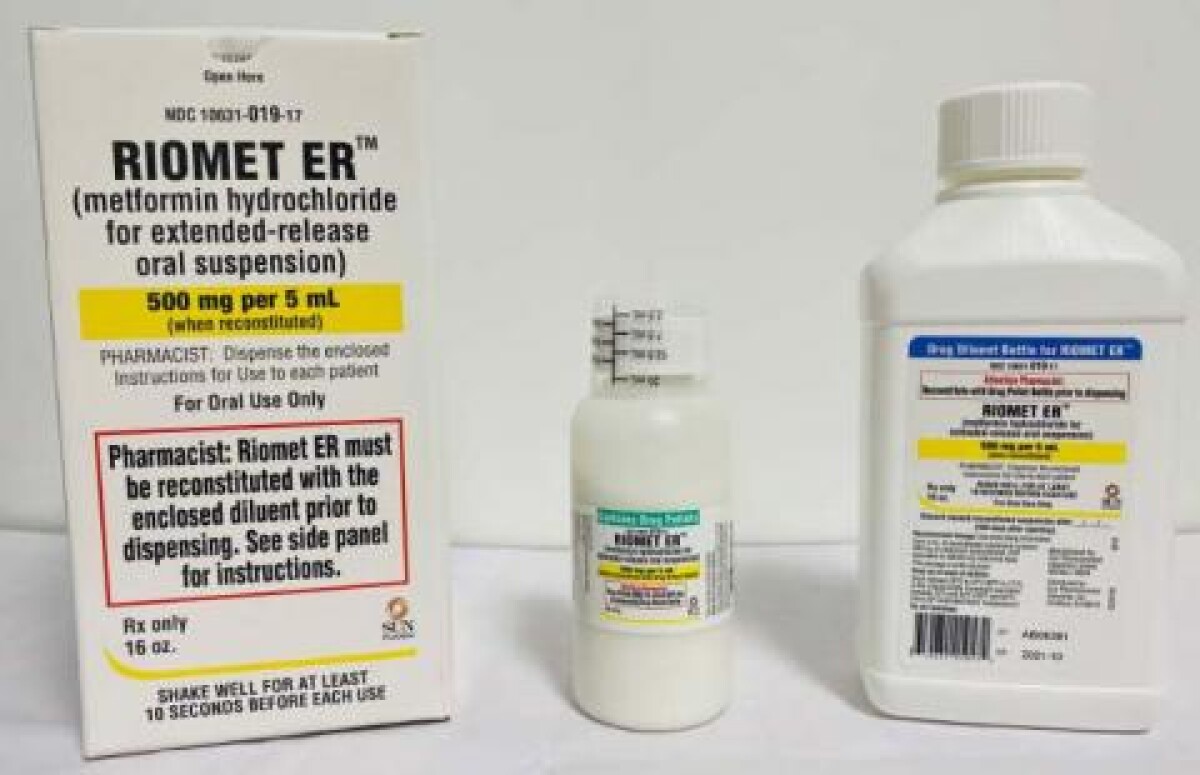
Nome da empresa: Sun Pharmaceutical IndustriNome da marca: Riomet ER
Produto recolhido: cloridrato de metformina para suspensão oral de libertação prolongada
Razão do recall: Devido à detecção de impureza N-Nitrosodimetilamina (NDMA)
Data de recall do FDA: 23 de setembro de 2020
Detalhes do recall: Sun Pharmaceutical Industries, Inc. (SUN PHARMA), uma subsidiária integral da Sun Pharmaceutical Industries Ltd. está recordando voluntariamente um lote de RIOMET ER™ (cloridrato de metformina para suspensão oral de liberação prolongada), 500 mg por 5 mL para o nível do consumidor. A razão para o recall deve-se ao nível de N-Nitrosodimetilamina (NDMA), que foi encontrado acima do limite permitido de ingestão diária aceitável (ADI) estabelecido pela Food and Drug Administration dos EUA. O NDMA é classificado como um provável carcinogénio humano (uma substância que pode causar cancro) com base nos resultados de testes laboratoriais.
NDMA é um contaminante ambiental conhecido e encontrado em água e alimentos, incluindo carnes, laticínios e vegetais. Até à data, a SUN PHARMA não recebeu nenhum relato de eventos adversos relacionados a este recall. RIOMET ER™ (cloridrato de metformina para suspensão oral de libertação prolongada) é um medicamento oral prescrito indicado como adjuvante à dieta e exercício físico para melhorar o controlo glicémico em adultos e doentes pediátricos com 10 anos de idade ou mais com diabetes mellitus tipo 2. O RIOMET ER™, quando reconstituído, é embalado em um frasco redondo de 473 mL. Cada embalagem contém um frasco de pastilhas medicamentosas, um frasco de diluente e um copo doseador. O RIOMET ER™ afetado é o seguinte lote:
- RIOMET ER™ (cloridrato de metformina para suspensão oral de libertação prolongada) 500 mg por 5 mL. Lote # AB06381. NDC #10631 -019-17. Data de expiração: 10/2021. Número de unidades: 747 caixas.
O produto pode ser identificado pelos frascos ou embalagens cartonadas como RIOMET ER™ (cloridrato de metformina para suspensão oral de libertação prolongada), contendo o Número de Lote específico e a Data de Expiração mencionados acima ou na rotulagem abaixo. O produto foi distribuído em todo o país para clientes grossistas.
A SUN PHARMA está notificando seus distribuidores e clientes por meio de seu coordenador de recall de terceiros (Inmar Inc.), via envio noturno padrão da FedEx e providenciará a devolução de todos os produtos recuperados.
Os distribuidores e retalhistas que têm RIOMET ER™ (cloridrato de metformina para suspensão oral de libertação prolongada), que está a ser recolhido, devem parar de distribuir e devolvê-la ao local de compra ou conforme indicado na notificação de recall.
Os doentes a tomar RIOMET ER™ (cloridrato de metformina para suspensão oral de libertação prolongada), 500 mg por 5 ml são aconselhados a continuar a tomar a medicação e contactar o seu farmacêutico, médico ou médico para aconselhamento sobre um tratamento alternativo. De acordo com a Food & Drug Administration dos EUA, pode ser perigoso para pacientes com esta condição grave parar de tomar sua metformina sem primeiro falar com seus profissionais de saúde. Visite o site da agência para obter mais informações em www.fda.gov/drugs/drug-safety-andavailability/fda-updates-and-press-announcements-ndma-metformin.
Os consumidores com dúvidas sobre este recall podem entrar em contato com a SUN PHARMA ligando para 1-800-818-4555 de segunda a sexta-feira entre 8:00am e 17:00pm EST ou enviando um e-mail para drug.safetyUSA@sunpharma.com. Os consumidores devem contactar o seu médico ou prestador de cuidados de saúde se tiverem tido quaisquer problemas que possam estar relacionados com a tomada ou utilização deste medicamento.
Verifique os detalhes completos do recall em www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/sun-pharmaceutical-industries-inc-issues-voluntary-nationwide-recall-riomet-ertm-metformin
Fonte: FDA
312
Comentários
Comentário