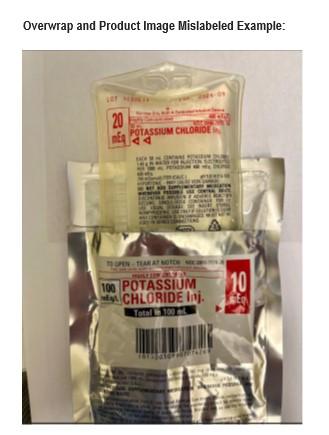
Recall notice
Inyección de Cloruro de Potasio retirada debido a Sobredosis de Cloruro de Potasio, USA
hace 3 meses •source fda.gov
United States
Otsuka ICU Medical LLC está emitiendo un retiro voluntario a nivel de usuario, para un lote MAL ETIQUETADO de CLORURO DE POTASIO Iny. 20 mEq, NDC 0990-7077-14. La etiqueta de SOBREENVOLTURA del lote 1030613, Fecha de Vencimiento: 30-09-2026 puede identificar incorrectamente el producto como CLORURO DE POTASIO Iny. 10 mEq con NDC 0990-7074-26. Otsuka ICU Medical LLC ha identificado esta discrepancia debido a un problema de fabricación. La dosificación está correctamente impresa en el etiquetado adherido a la bolsa del producto que no es visible cuando la SOBREENVOLTURA de 10 mEq está en su lugar. Esta notificación detalla el problema y los pasos requeridos que debe realizar. El lote de producto afectado fue fabricado el 15 de abril de 2025 y distribuido en Estados Unidos entre el 23 de mayo de 2025 y el 26 de agosto de 2025.Si se usa la dosificación incorrecta en la sobreenvoltura de 10 mEq en lugar de la dosificación correcta de 20mEq impresa en el producto, es posible una sobredosis de cloruro de potasio. La sobredosis de cloruro de potasio puede llevar a hipercalemia. Los peligros de la hipercalemia severa después de grandes sobredosis intravenosas causan disfunción neuromuscular incluyendo debilidad muscular, parálisis ascendente, apatía, vértigo, confusión mental, hipotensión, disritmias cardíacas, o muerte por paro cardíaco. Los bebés prematuros, pacientes con nutrición parenteral crónica, pacientes que tienen historial de arritmias cardíacas, pacientes con insuficiencia renal crónica, pacientes que tienen falla renal aguda, pacientes con diuréticos ahorradores de potasio—todos están en riesgo de resultados adversos y potencialmente fatales. Otsuka ICU Medical LLC no ha recibido reportes de eventos adversos asociados con este problema hasta la fecha.
El lote de producto afectado (Ubicado en la parte superior izquierda de la bolsa del producto o la etiqueta del estuche es:
- NÚMERO NDC: 0990-7077-14
- NÚMERO DE LISTA: 070770452
- PRODUCTO: Inyección de Cloruro de Potasio 20 mEq
- NÚMERO DE LOTE: 1030613
- FECHA DE VENCIMIENTO: 30 de septiembre de 2026
- CONFIGURACIÓN: 50 mL en Contenedor Flexible
- NÚMERO NDC: 0990-7074-26
- NÚMERO DE LISTA: 070740452
- PRODUCTO: Inyección de Cloruro de Potasio 10 mEq
- NÚMERO DE LOTE: N/A
- FECHA DE VENCIMIENTO: N/A
- CONFIGURACIÓN: 100 mL en Contenedor Flexible
DESCRIPCIÓN DE LOS ESTUCHES QUE SE ESTÁN RETIRANDO:
- NÚMERO NDC: 0990-7077-14
- NÚMERO DE CÓDIGO DE BARRAS: (01)20309907077141
- NÚMERO DE LOTE: 1030613
- FECHA DE VENCIMIENTO: 30 de septiembre de 2026
- CONFIGURACIÓN: 24 por estuche
La Administración de Alimentos y Medicamentos de EE.UU. (FDA) ha sido notificada de esta acción.
Fuente: www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/otsuka-icu-medical-llc-issues-voluntary-nationwide-recall-20-meq-potassium-chloride-injection-due
Comentarios
Comentario