Estafa, Cloverdale Ct, Statesville, NC, USA
hace 4 semanas •reported by user-tfhv7513
746 South Glasgow Ave, Inglewood, CA 90301
Mar 12, 2021
Como plataforma de informes de la comunidad global centrada en el bienestar de los consumidores, recibimos una amplia gama de informes. Desde el lanzamiento de las vacunas contra la COVID-19, hemos acumulado informes que transmiten las experiencias de las personas tras recibir dosis de las vacunas actualmente aprobadas, por ejemplo, Moderna, Pfizer, Jansen, Johnson & Johnson y Oxford-AstraZeneca. Nos hemos tomado un tiempo para analizar y clasificar los resultados hasta el momento, para poder compartirlos con nuestra comunidad y con otras personas que puedan encontrar esto útil
.Esperamos que al compartir esta información, las personas se sientan mejor informadas sobre la variedad de posibles resultados a medida que avanzan con sus vacunas y, para quienes ya se han vacunado, esperamos que los resultados sirvan de consuelo al saber que no son los únicos que sufren ciertos efectos secundarios.
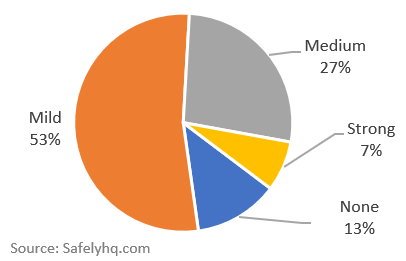
Desglose porcentual de los efectos secundarios de la COVID-19. Fuente: SafelyHQ.com
Para clasificar los informes, utilizamos el siguiente enfoque:
Importante: Esta historia se centra en la comparación entre Moderna y Pfizer. Consulte nuestras notas de datos en la parte inferior sobre el sesgo en la notificación y la distorsión de los datos. No estamos concluyendo que solo el 13% de los receptores de la vacuna escaparán a los efectos secundarios.

Comparación de los efectos secundarios de la COVID-19: Pfizer vs Moderna. Fuente: SafelyHQ.com
Con más frecuencia, vimos informes sin efectos secundarios de Pfizer y, cuando se informaron efectos secundarios de Pfizer, con más frecuencia se notificaron como leves que como de Moderna.
De las personas que experimentaron efectos secundarios, las menciones más comunes se muestran a continuación. Excluimos el dolor, ya que era común en la mayoría de los informes
.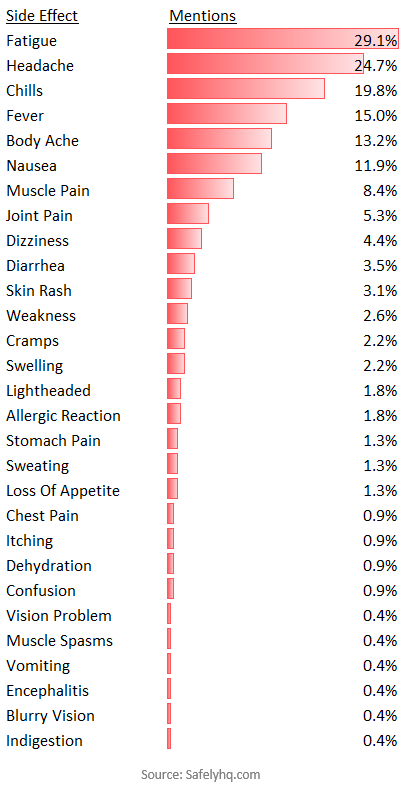
Los efectos secundarios de la vacuna contra la COVID-19 notificados con más frecuencia. Fuente: SafelyHQ.com
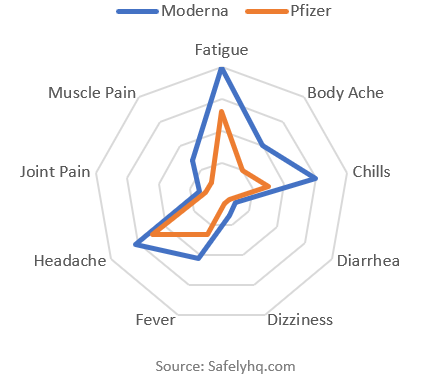
Las 10 principales menciones de efectos secundarios que comparan Pfizer y Moderna Fuente: SafelyHQ.com
Esto muestra las 10 principales menciones por vacuna (nuevamente excluyendo el dolor). Moderna tiene más menciones para cada efecto secundario. Moderna tiene muchas más menciones de efectos secundarios por informe, en total un 60% más que Pfizer
.Un ejemplo de informe «Sin efectos secundarios»:
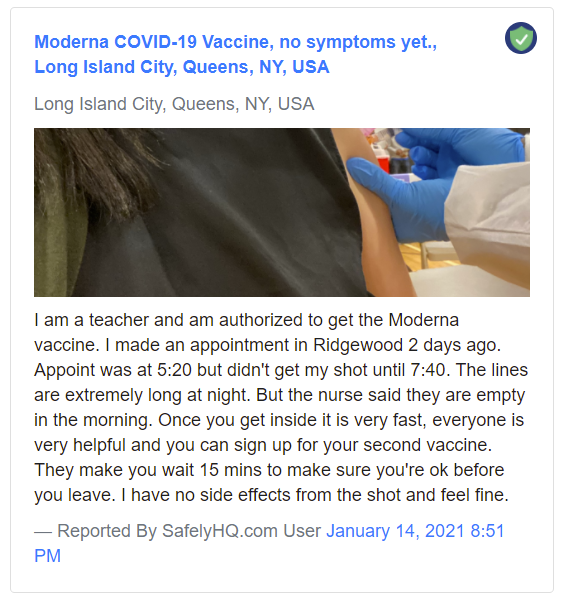
Ejemplo de informe «Sin efectos secundarios». Fuente: SafelyHQ.com — Enlace
Un ejemplo de informe «leve»:
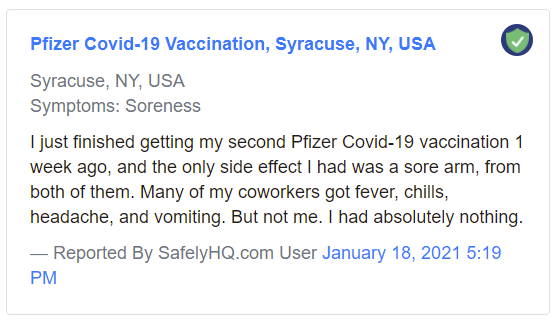
Ejemplo de informe «leve». Fuente: SafelyHQ.com — Enlace
Un ejemplo de informe «Medio»:
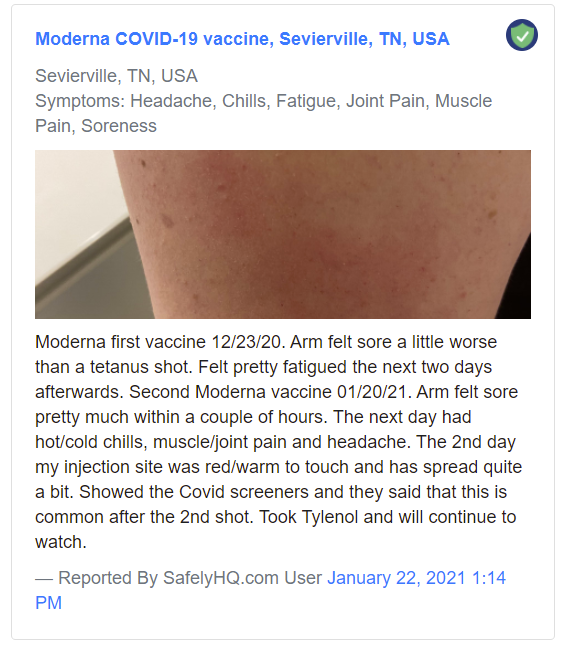
Ejemplo de informe «Medio». Fuente: SafelyHQ.com — Enlace
Un ejemplo de informe de «efectos secundarios fuertes»:

Ejemplo de informe de «efectos secundarios fuertes». Fuente: SafelyHQ.com — Enlace
Le invitamos a suscribirse a nuestra lista de correo electrónico gratuita. Obtenga información sobre los nuevos análisis, reciba las últimas noticias y reciba actualizaciones a medida que lleguen nuevos informes. Para registrarte haz clic aquí.
Hemos recibido informes sobre otras vacunas, pero hasta ahora no hay datos suficientes para incluirlos en este análisis. Nos encantaría que compartieras tu experiencia si recibió una de estas vacunas. Para compartir tu experiencia haz clic aquí.
Puede ver los informes en nuestra página de inicio sobre la vacuna contra la covid-19 aquí.
Le invitamos a compartir su experiencia. Simplemente vaya a nuestra página de inicio sobre la vacuna contra la covid-19 y complete el formulario que se muestra a continuación. Para empezar haz clic aquí
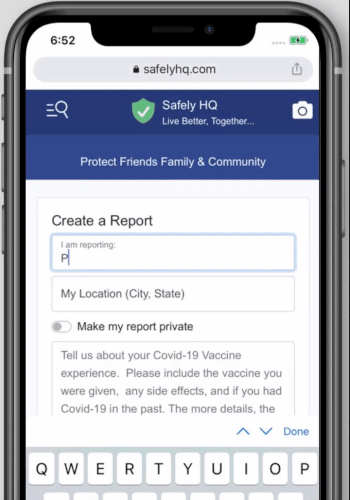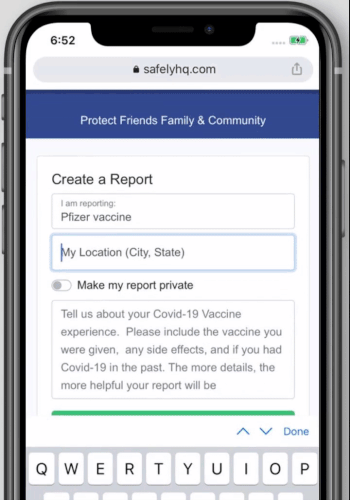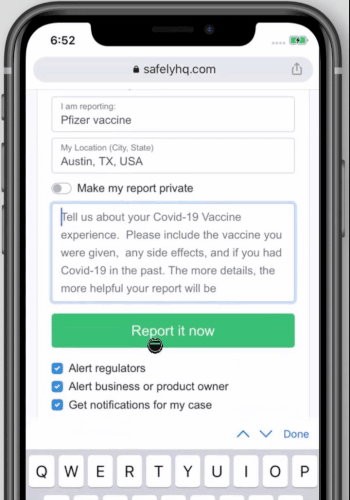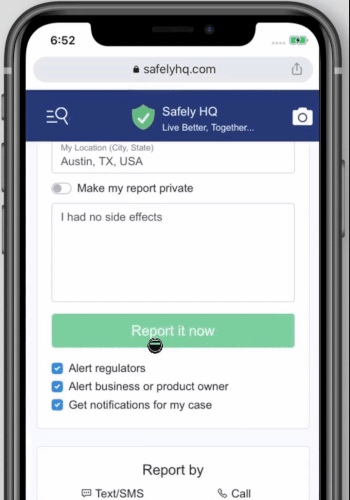
Cómo compartir su experiencia con la vacuna contra la COVID-19 en safelyhq.com
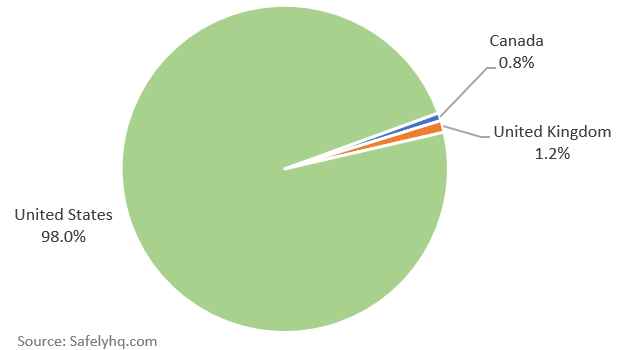
Informes de efectos secundarios de la vacuna contra la COVID-19 por país. Fuente: SafelyHQ.com
Hemos recibido informes de la mayoría de los estados de EE. UU., y la mayor participación proviene de California, Texas y Florida.
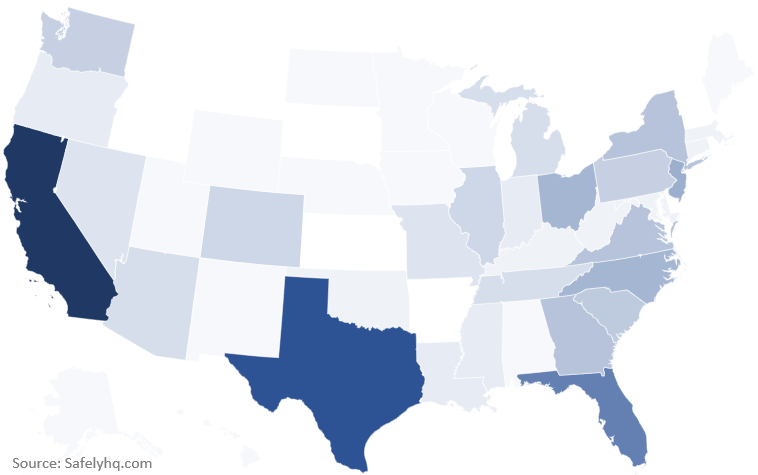
Fuente de los informes sobre la vacuna contra la COVID-19 de EE. UU. por estado. Fuente: SafelyHQ.com
hace 4 semanas •reported by user-tfhv7513
hace 3 semanas •reported by user-rcjd6867
hace 3 semanas •reported by user-prkj4722
hace 3 semanas •reported by user-vxnbm942
hace 3 semanas •reported by user-bkmt6716
hace 2 días •reported by user-rpzm2696
hace 1 semana •reported by user-qwdky314
hace 3 semanas •source www.fda.gov
Recall notice
hace 3 semanas •reported by user-ydfg4319
hace 2 semanas •reported by user-zcwn4673
IMPORTANTE: SU INFORME ESTÁ EN COLA: PUEDE TOMAR HASTA 12 HORAS PARA QUE SU INFORME SE muestre EN NUESTRA PÁGINA DE INICIO (SI NO SE OPTA COMO PRIVADO)
Visite nuestras páginas de aprendizaje para obtener más información útil o envíenos un correo electrónico: support@safelyhq.com
Search