Recall notice
Fresenius Kabi USA Dexmédétomidine HCL dans l'injection de chlorure de sodium à 0,9 % - rappel en raison d'une contamination croisée par la lidocaïne, USA
il y a 5 ans •source fda.gov
United States
Nom de la société : Fresenius Kabi USANom de marque : Fresenius Kabi USA
Produit rappelé : Dexmédétomidine HCL dans l'injection de chlorure de sodium à 0,9 %
Motif du rappel : Contamination croisée par la lidocaïne
Date de rappel de la FDA : 19 novembre 2020
Détails du rappel : Fresenius Kabi USA retire volontairement un lot unique de Dexmédétomidine HCl dans une injection de chlorure de sodium à 0,9%, 200 mcg/50 mL (4 mcg/mL), 50 mL dans un flacon de 50 mL. Fresenius Kabi a initié ce rappel en raison d'une trace de lidocaïne présente dans le lot. Ce rappel est effectué au niveau de l'utilisateur. À ce jour, aucune déclaration d'expérience indésirable n'a été reçue pour le lot rappelé. L'administration de Dexmédétomidine HCl contenant des traces de lidocaïne à un patient allergique à la lidocaïne pourrait entraîner une réaction allergique potentiellement mortelle.
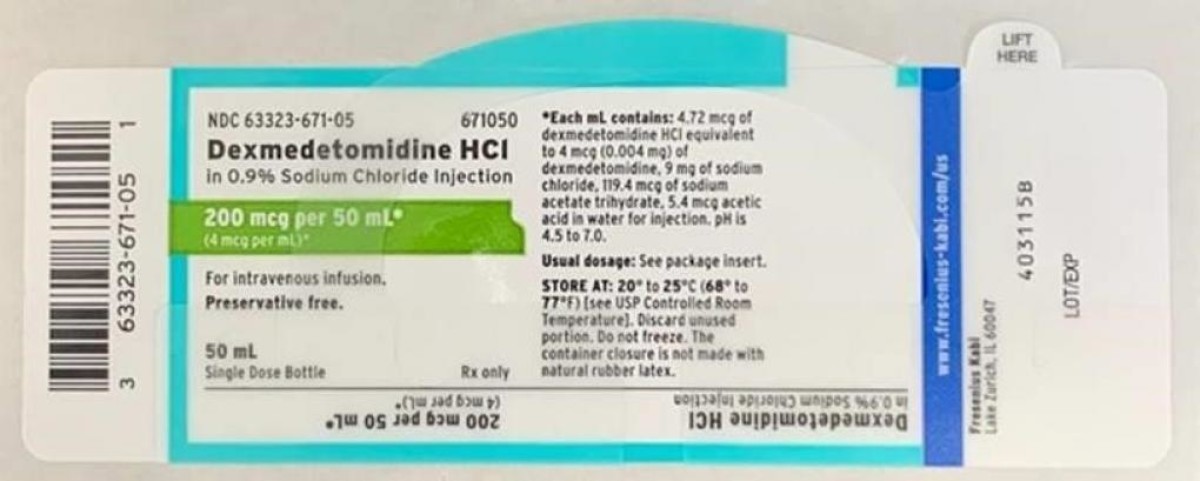
Le chlorhydrate de dexmédétomidine dans 0,9 % de chlorure de sodium injectable est approuvé pour usage intraveineux et indiqué pour la sédation chez les patients non intubés avant et/ou pendant la chirurgie et d'autres interventions. Vous trouverez ci-dessous un tableau du lot rappelant distribué à l'échelle nationale aux grossistes, aux distributeurs, aux hôpitaux et aux pharmacies entre le 9 avril 2020 et le 13 avril 2020. Une image de l'étiquette est également incluse ci-dessous.
- Dexmédétomidine HCl dans 0,9 %. Chlorure de sodium injectable, 200 mcg/50 mL (4 mcg/ml), 50 mL, remplir un flacon de 50 mL. Numéro CND : 63323-671-50. Code produit : 671050. Numéro de lot : 6123925. Date d'expiration : 03/2022. Date de la première expédition : 04/09/2020. Date de dernière expédition : 13/04/2020
Fresenius Kabi informe ses distributeurs et clients par lettre et leur demande de vérifier immédiatement leurs stocks, de mettre en quarantaine et d'interrompre l'utilisation et la distribution de tout produit concerné.
Les distributeurs doivent aviser leurs clients et les ordonner de mettre en quarantaine et cesser de distribuer ou de distribuer les lots concernés, et de retourner le produit à Fresenius Kabi.
Les clients qui ont des questions concernant ce rappel peuvent communiquer avec Fresenius Kabi au 1-866-716-2459 du lundi au vendredi, de 8 h à 17 h, heure du Centre. Les consommateurs devraient communiquer avec leur médecin ou fournisseur de soins de santé s'ils ont éprouvé des problèmes pouvant être liés à la prise ou à l'utilisation de ce produit pharmaceutique.
Consultez les détails complets du rappel sur www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/fresenius-kabi-issues-voluntary-nationwide-recall-single-lot-dexmedetomidine-hydrochloride-injection
Source : FDA
312
Commentaires
Commentaire